题目内容
【题目】下列说法正确的是
A. 通过化学变化可以实现16O与18O之间的转化
B. 因为H2O的沸点高于H2S,所以O原子得电子能力大于S原子
C. 某化合物熔融状态下能导电,该化合物中一定有离子键
D. 16O2与18O2互为同素异形体
【答案】C
【解析】
A.同位素之间的转化需通过核变化才能实现,故A错误;
B.水分子间存在氢键,导致H2O的沸点高于H2S,与O、S的得电子能力无关,故B错误;
C.熔融状态能导电的化合物一定是离子化合物,只有离子化合物在熔融状态下电离出自由移动的离子,一定含离子键,故C正确;
D.16O2与18O2均表示氧气分子,二者不互为同素异形体,故D错误;
答案为C。

练习册系列答案
相关题目
【题目】碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl)制备碱式碳酸铜,其制备过程如下: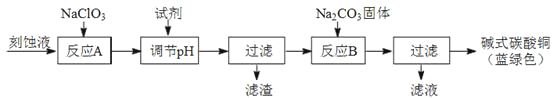
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是;
②反应A后调节溶液的pH范围应为。
③第一次过滤得到的产品洗涤时,如何判断已经洗净?。
④造成蓝绿色产品中混有CuO杂质的原因是。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。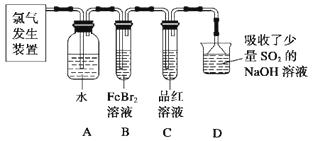
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏有。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因。此时B装置中发生反应的离子方程式是。
③写出A溶液中具有强氧化性微粒的化学式。若向A溶液中加入NaHCO3粉末,会观察到的现象是。