题目内容
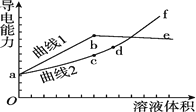
【题目】某温度下,在2 L恒容密闭容器中投入一定量的A、B,发生反应:3A(g)+bB(g)![]() cC(g)+2D(s),12 s时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中正确的是
cC(g)+2D(s),12 s时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中正确的是

A.图中两曲线相交时,A的消耗速率等于A的生成速率
B.0-2 s,D的平均反应速率为0.1 mol·L-1·s-1
C.化学计量系数之比b:c=1:4
D.12 s时,A的转化率为75%
【答案】D
【解析】
A.交点时,随时间变化A的浓度发生变化,反应未达到平衡状态,故A的消耗速率不等于A的生成速率,A错误;
B.D是固体物质,浓度不变,因此不能使用固体物质表示反应速率,B错误;
C.根据图象可知,12 s时反应达到平衡,A的浓度变化△c(A)=0.8 mol/L-0.2 mol/L=0.6 mol/L,B的浓度变化△c(B)=0.5 mol/L-0.3 mol/L=0.2 mol/L,C的物质的量浓度变化△c(C)=0.8 mol÷2 L=0.4 mol/L, 它们反应时变化的物质的量浓度比等于化学方程式中化学计量数之比,3:b:c=0.6:0.2:0.4,解得:b=1,c=2,化学计量数之比b:c=1:2,C错误;
D.12 s内△c(A)=0.8 mol/L-0.2 mol/L=0.6 mol/L,所以A的转化率为![]() ×100%=75%,D正确;
×100%=75%,D正确;
故合理选项是D。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】不同温度下,三个体积均为1L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
容器编号 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | ||||
CH4 | NO2 | N2 | CO2 | H2O | NO2 | ||
I | T1 | 0.50 | 1.2 | 0 | 0 | 0 | 0.40 |
II | T2 | 0.30 | 0.80 | 0.20 | 0.20 | 0.40 | 0.60 |
III | T3 | 0.40 | 0.70 | 0.70 | 0.70 | 1.0 | |
A.T1<T2
B.若升高温度,正反应速率减小,逆反应速率增大,平衡逆移
C.平衡时,容器I中反应放出的热量为693.6 kJ
D.容器III中反应起始时v 正(CH4) <v逆(CH4)