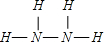题目内容
已知过氧化氢(H2O2)中氧元素呈现-1价.(1)若向酸性高锰酸钾溶液中加入过氧化氢,过氧化氢将转化为
(2)若向氢硫酸(H2S)中加入过氧化氢,过氧化氢将转化为
分析:过氧化氢中氧元素化合价处于中间价态,所以既具有氧化性又具有还原性.遇到强的氧化剂高锰酸钾表现出还原性被氧化生成氧气,遇到强的还原剂硫化氢表现为氧化性,将硫化氢氧化成硫单质.
解答:解:(1)酸性高锰酸钾具有强的氧化性,过氧化氢中氧处于-1价具有还原性,被氧化生成氧气,高锰酸钾被还原成锰离子,所以会看到有气泡冒出,高锰酸钾褪色;
故答案为:氧气;气泡冒出,高锰酸钾褪色;
(2)氢硫酸(H2S)具有强的还原性,过氧化氢中氧处于-1价具有氧化性,可以将硫化氢中的硫氧化成单质硫,本身被还原为水,生成的硫单质不溶溶于水,所以会看到有沉淀产生,
故答案为:水; 有沉淀生成.
故答案为:氧气;气泡冒出,高锰酸钾褪色;
(2)氢硫酸(H2S)具有强的还原性,过氧化氢中氧处于-1价具有氧化性,可以将硫化氢中的硫氧化成单质硫,本身被还原为水,生成的硫单质不溶溶于水,所以会看到有沉淀产生,
故答案为:水; 有沉淀生成.
点评:本题考查了过氧化氢的性质,解题是注意抓住过氧化氢中氧元素的化合价处于中间价态,既有还原性有具有氧化性,结合氧化还原反应的规律判断过氧化氢的性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
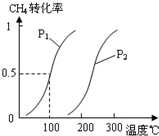 A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:
A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题: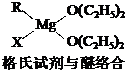
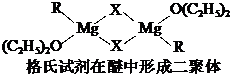
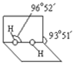 (4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
 R(OH)3
R(OH)3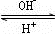 [R(OH)4]-
[R(OH)4]-