题目内容
X、Y、Z均为第三周期元素,X的第一电离能在同周期中最小,Y的电负性在同周期中最大,Z的离子半径在同周期中最小,下列关于X、Y、Z叙述中不正确的是
- A.原子序数和原子半径大小顺序均为:X<Y<Z
- B.元素X与元素Y能形成离子化合物
- C.元素Z最高价氧化物对应水化物具有两性
- D.元素Y形成的气态氢化物水溶液呈强酸性
A
同周期自左向右电离能逐渐增大,所以X是Na。非金属性越强,电负性越大,因此Y是Cl。离子半径最小的是铝离子,所以Z是Al。同周期自左向右,原子半径逐渐减小,原子序数逐渐增大,A不正确。氯化钠是离子化合物,B正确。氢氧化铝是两性氢氧化物,C正确。氯化氢的水溶液是盐酸,显强酸性,D正确。答案选A。
同周期自左向右电离能逐渐增大,所以X是Na。非金属性越强,电负性越大,因此Y是Cl。离子半径最小的是铝离子,所以Z是Al。同周期自左向右,原子半径逐渐减小,原子序数逐渐增大,A不正确。氯化钠是离子化合物,B正确。氢氧化铝是两性氢氧化物,C正确。氯化氢的水溶液是盐酸,显强酸性,D正确。答案选A。

练习册系列答案
相关题目
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
|
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
|
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
|
Z元素的族序数是其周期数的三倍 |
|
W原子的第一至第六电离能分别为:I1=578KJ·mol-1 I2=1817KJ·mol-1 I3=2745KJ·mol-1 I4=11575KJ·mol-1 I5=14830KJ·mol-1 I6=18376KJ·mol-1 |
|
Q为前四周期中电负性最小的元素 |
|
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
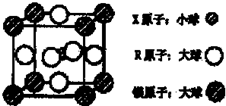
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为 ;晶体中每个镁原子周围距离最近的R原子有 个。
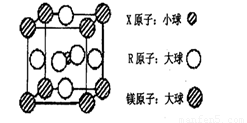
 或
或