题目内容
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
回答下列问题:
(1)Y元素的基态原子的电子排布式为
(2)X的氯化物的熔点比Q的氯化物的熔点
是
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示.则该晶体的化学式为
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578kJ?mol-1;I2=1817kJ?mol-1;I3=2745kJ?mol-1; I4=11575kJ?mol-1 ;I5=14830kJ?mol-1 ;I6=18376kJ?mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |
(1)Y元素的基态原子的电子排布式为
1s22s22p3
1s22s22p3
;其第一电离能比Z元素原子的第一电离能高
高
(填“高”或“低”).(2)X的氯化物的熔点比Q的氯化物的熔点
低
低
(填“高”或“低”),理由
是
CCl4属于分子晶体,KCl属于离子晶体
CCl4属于分子晶体,KCl属于离子晶体
.(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)
ac
ac
.a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示.则该晶体的化学式为
MgNi3C
MgNi3C
;晶体中每个镁原子周围距离最近的R原子有12
12
个.分析:X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,则核外电子排布为1s22s22p2,则X为碳元素;
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应,则Y为氮元素;
Z元素的族序数是其周期数的三倍,则Z为氧元素;
W原子的第四电离能剧增,表现+3价,则W为Al元素;
Q为前四周期中电负性最小的元素,则Q为钾元素;
元素R位于周期表的第10列,原子序数大于K元素,处于第四周期,为Ni元素,
然后利用原子结构及分子的空间构型来解答.
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,则核外电子排布为1s22s22p2,则X为碳元素;
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应,则Y为氮元素;
Z元素的族序数是其周期数的三倍,则Z为氧元素;
W原子的第四电离能剧增,表现+3价,则W为Al元素;
Q为前四周期中电负性最小的元素,则Q为钾元素;
元素R位于周期表的第10列,原子序数大于K元素,处于第四周期,为Ni元素,
然后利用原子结构及分子的空间构型来解答.
解答:解:X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大:X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,则核外电子排布为1s22s22p2,则X为碳元素;Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应,则Y为氮元素;Z元素的族序数是其周期数的三倍,则Z为氧元素;W原子的第四电离能剧增,表现+3价,则W为Al元素;Q为前四周期中电负性最小的元素,则Q为钾元素;元素R位于周期表的第10列,原子序数大于K元素,处于第四周期,为Ni元素,
(1)Y为氮元素,原子核外电子数为7,基态原子的电子排布式为1s22s22p3;氮原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能比O元素原子的第一电离能高,
故答案为:1s22s22p3;高;
(2)X的氯化物为CCl4,属于分子晶体,Q的氯化物为KCl,属于离子晶体,故熔点CCl4<KCl,
故答案为:低;CCl4属于分子晶体,KCl属于离子晶体;
(3)光谱证实元素Al的单质与强碱性溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存在配位键、极性共价键,
故答案为:ac;
(4)含有C、Ni和镁三种元素的某种晶体具有超导性,根据晶胞结构可知,晶胞中Mg原子数目为8×
=1,C原子数目为1,Ni原子数目为6×
=3,则该晶体的化学式为MgNi3C;晶体中每个镁原子周围距离最近的Ni原子处于以Mg为顶点的面心上,补全晶胞可知,Mg原子为12个面共用,故晶体中每个镁原子周围距离最近的Ni原子有12个,
故答案为:MgNi3C;12.
(1)Y为氮元素,原子核外电子数为7,基态原子的电子排布式为1s22s22p3;氮原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能比O元素原子的第一电离能高,
故答案为:1s22s22p3;高;
(2)X的氯化物为CCl4,属于分子晶体,Q的氯化物为KCl,属于离子晶体,故熔点CCl4<KCl,
故答案为:低;CCl4属于分子晶体,KCl属于离子晶体;
(3)光谱证实元素Al的单质与强碱性溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存在配位键、极性共价键,
故答案为:ac;
(4)含有C、Ni和镁三种元素的某种晶体具有超导性,根据晶胞结构可知,晶胞中Mg原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:MgNi3C;12.
点评:本题考查结构性质位置关系、核外电子排布规律、电离能、化学键、晶胞结构及计算等,难度中等,推断元素是解题关键,注意利用均摊法进行晶胞的有关计算.

练习册系列答案
相关题目
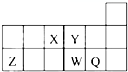 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图,下列说法正确的是( )| A、元素Y最高正化合价与最低负化合价的绝对值之和的数值等于8 | B、原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q) | C、离子Y2-和Z3+半径的大小顺序为:r(Y2-)>r(Z3+) | D、元素W的最高价氧化物对应的水化物的酸性比Q的强 |
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的( ) (2012?天津模拟)短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
(2012?天津模拟)短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )