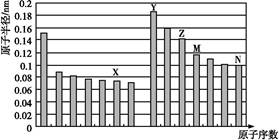
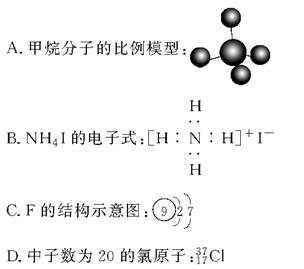
题目内容
锌(Zinc)是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池制造有不可磨灭的贡献。
Ⅰ.湿法炼锌
某种冶炼过程可用下图简略表示
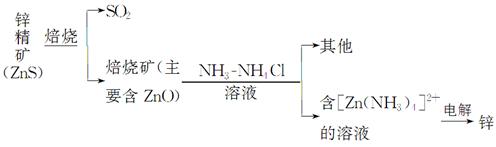
(1)ZnS焙烧反应的化学方程式为_____________________________________。
(2)电解过程中析锌一极的电极反应式为_______________________________。
(3)氧化锌像氧化铝一样,属于两性氧化物,则氧化锌与氢氧化钠反应的离子方程式为_________________________________________________________。
(已知:“锌酸”的化学式可写成H2[Zn(OH)4])
Ⅱ.锌电池
用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等。
(4)锌锰碱性电池,以二氧化锰为正极,锌粒为负极,氢氧化钾溶液为电解液。其具有容量大、放电电流大的特点,因而得到广泛应用。电池总反应式为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。
碱性电池中,负极锌由片状改变成粒状的优点是_______________________;正极反应式为________________________________________________________________________。
(5)新型锌空电池(如图)与锂电池相比,锌空气充电电池的储存电量是它的三倍,成本是锂电池的一半,并且完全没有过热爆炸的安全隐患。该电池的总反应为2Zn+O2=2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为__________________________。若以该电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有10.8 g银析出,至少需要________L空气(折算成标准状况)进入该电池。

Ⅰ.湿法炼锌
某种冶炼过程可用下图简略表示

(1)ZnS焙烧反应的化学方程式为_____________________________________。
(2)电解过程中析锌一极的电极反应式为_______________________________。
(3)氧化锌像氧化铝一样,属于两性氧化物,则氧化锌与氢氧化钠反应的离子方程式为_________________________________________________________。
(已知:“锌酸”的化学式可写成H2[Zn(OH)4])
Ⅱ.锌电池
用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等。
(4)锌锰碱性电池,以二氧化锰为正极,锌粒为负极,氢氧化钾溶液为电解液。其具有容量大、放电电流大的特点,因而得到广泛应用。电池总反应式为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。
碱性电池中,负极锌由片状改变成粒状的优点是_______________________;正极反应式为________________________________________________________________________。
(5)新型锌空电池(如图)与锂电池相比,锌空气充电电池的储存电量是它的三倍,成本是锂电池的一半,并且完全没有过热爆炸的安全隐患。该电池的总反应为2Zn+O2=2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为__________________________。若以该电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有10.8 g银析出,至少需要________L空气(折算成标准状况)进入该电池。

(1)2ZnS+3O2 2SO2+2ZnO
2SO2+2ZnO
(2)[Zn(NH3)4]2++2e-=Zn+4NH3↑
(3)ZnO+2OH-+H2O=[Zn(OH)4]2-
(4)增大了负极的反应面积,提高了放电效率 2MnO2+2H2O+2e-=2MnO(OH)+2OH-
(5)Zn-2e-+2OH-=ZnO+H2O 2.8(2.7也可)
 2SO2+2ZnO
2SO2+2ZnO(2)[Zn(NH3)4]2++2e-=Zn+4NH3↑
(3)ZnO+2OH-+H2O=[Zn(OH)4]2-
(4)增大了负极的反应面积,提高了放电效率 2MnO2+2H2O+2e-=2MnO(OH)+2OH-
(5)Zn-2e-+2OH-=ZnO+H2O 2.8(2.7也可)
(2)析锌一极应是[Zn(NH3)4]2+得到电子,还原为锌,同时释放出氨气。(4)碱性锌锰电池中,负极锌失电子生成锌离子,再与溶液中的氢氧根结合生成氢氧化锌,负极反应:Zn+2OH--2e-=Zn(OH)2,正极反应:2MnO2+2H2O+2e-=2MnO(OH)+2OH-。(5)锌空电池的负极反应式为2Zn-4e-+4OH-=2ZnO+2H2O,正极反应式为O2+4e-+2H2O=4OH-,用惰性电极电解硝酸银溶液的阴极反应式为Ag++e-=Ag,则有O2~4e-~4Ag,V(空气)= ×22.4 L·mol-1=2.8 L。
×22.4 L·mol-1=2.8 L。
 ×22.4 L·mol-1=2.8 L。
×22.4 L·mol-1=2.8 L。
练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目