��Ŀ����
����Ŀ���㶹����һ����;�㷺�����ϣ������������㾫�Լ��������û�ױƷ�������ȡ����л���M���л���A�ϳ��㶹�ص��������£�

��֪������Ϣ��
��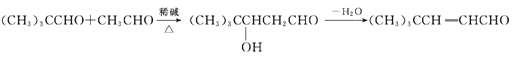
�� M�ķ���ʽΪC2H6O����������3�ֻ�ѧ������ͬ����ԭ��
�� �㶹���к���������Ԫ��
(l) M�Ļ�ѧ������______����M����B�Ļ�ѧ����ʽΪ_______��
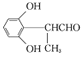
(2) A�Ľṹ��ʽΪ________��
(3) Dת��ΪE�ĵڢٲ�������Լ�����Ӧ������________��
(4����E�����㶹�صĻ�ѧ����ʽΪ________��
(5��д����������������C��һ��ͬ���칹��Ľṹ��ʽ��________��
�� �ܷ���������Ӧ �� 1mol C��ȫ��Ӧ������2 mol NaOH
�� ��������3��ȡ���� �� �����ϵ�һ�ȴ���ֻ��2��
���𰸡� �Ҵ� 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O ![]() ������Һ��ˮԡ���ȣ�������������ͭ����Һ�����ȡ����������Ը��������Һ����������˫������������Ҳ������O2�������������ǻ���
������Һ��ˮԡ���ȣ�������������ͭ����Һ�����ȡ����������Ը��������Һ����������˫������������Ҳ������O2�������������ǻ��� 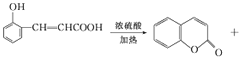 H2O
H2O 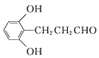 ��
�� ��
�� ��
�� ����дһ�֣�
����дһ�֣�
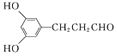
�����������������Լ���֪�٢ڿ�֪A��B������ȩ������MΪ�Ҵ���BΪ��ȩ��AΪ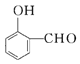 ��������֪�� �㶹���к���������Ԫ������ӦΪEͨ���������������ã����㶹��Ϊ��
��������֪�� �㶹���к���������Ԫ������ӦΪEͨ���������������ã����㶹��Ϊ��![]() ��(l) M�Ļ�ѧ�������Ҵ�����M����B�Ļ�ѧ����ʽΪ2CH3CH2OH+O2
��(l) M�Ļ�ѧ�������Ҵ�����M����B�Ļ�ѧ����ʽΪ2CH3CH2OH+O2![]() 2CH3CHO+2H2O��(2) A�Ľṹ��ʽΪ
2CH3CHO+2H2O��(2) A�Ľṹ��ʽΪ ��(3) Dת��ΪE�ĵڢٲ���ȩ�����������ᣬ������Լ�����Ӧ������������Һ��ˮԡ���ȣ�������������ͭ����Һ�����ȡ����������Ը��������Һ����������˫������������Ҳ������O2�������������ǻ�����(4����E�������������������㶹�صĻ�ѧ����ʽΪ��
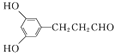
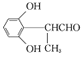
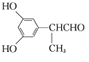
��(3) Dת��ΪE�ĵڢٲ���ȩ�����������ᣬ������Լ�����Ӧ������������Һ��ˮԡ���ȣ�������������ͭ����Һ�����ȡ����������Ը��������Һ����������˫������������Ҳ������O2�������������ǻ�����(4����E�������������������㶹�صĻ�ѧ����ʽΪ��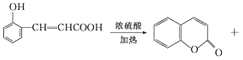 H2O��(5��C��ͬ���칹�壺�� �ܷ���������Ӧ֤���ṹ�к���ȩ����
H2O��(5��C��ͬ���칹�壺�� �ܷ���������Ӧ֤���ṹ�к���ȩ����
�� ��������3��ȡ������ �����ϵ�һ�ȴ���ֻ��2�֣����Ӹ߶ȶԳ���Ӧ��������ȡ������һ���ģ��� 1mol C��ȫ��Ӧ������2 mol NaOH��ȩ�������������Ʒ�Ӧ���������ȡ����Ӧ���Ƿ��ǻ�����������������ͬ���칹���У� ��
�� ��
�� ��
�� ��
��

 �̲�ȫ���ִʾ�ƪϵ�д�
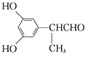
�̲�ȫ���ִʾ�ƪϵ�д�����Ŀ����κ�ữѧ����Ϊ4�ǻ�3����������ᣬ������ҽҩ������Ʒ����ױƷԭ�Ϻ�ʳƷ���Ӽ����ṹ��ʽΪ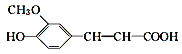 ���ڰ�κ����Һ�м�������Լ�(���Լ���)������������š������Լ��������۶���ȷ���ǣ� ��
���ڰ�κ����Һ�м�������Լ�(���Լ���)������������š������Լ��������۶���ȷ���ǣ� ��
ѡ�� | �Լ� | ���� | ���� |
A | �Ȼ�����Һ | ��Һ����ɫ | �����з��ǻ� |
B | ������Һ | �������� | ������ȩ�� |
C | ̼��������Һ | �������� | �������Ȼ� |
D | ��ˮ | ��Һ��ɫ | ������̼̼˫�� |
A. A B. B C. C D. D
����Ŀ��ij��ѧ����С���������ͼ��ʾ��װ����ȡ����������ͼ�мг������ͼ���װ������ȥ������ش��������⣺

(1)ˮ�������ܵ�______���a����b���������롣
(2)��֪�������ݣ�
�Ҵ� | ���� | �������� | 98%Ũ���� | |
�۵�/�� | ��117.3 | 16.6 | ��83.6 | �� |
�е�/�� | 78.5 | 117.9 | 77.5 | 338.0 |
��֪�¶ȸ���140��ʱ��������Ӧ��2CH3CH2OH��CH3CH2OCH2CH3+H2O
�ٸø���Ӧ����__________��Ӧ������ĸ����
a���ӳ� b��ȡ�� c������
�ڿ��ǵ���Ӧ���ʵȶ������أ�������װ���Ʊ���������ʱ����Ӧ������¶ȷ�Χ��______������ĸ����
a��T��77.5�� b��T��150�� c��115�棼T��130��
(3)����ʵ���б���̼������Һ�������ǣ�����ĸ����___________��
A���к�������Ҵ�
B���к����Ტ���ղ����Ҵ�
C�����������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�и�С�������ڷֲ�����
D�������������ɣ���������
(4)�����������������Ӧʹ�õķ��뷽����__________��������������ƣ���ͬ�������õ�������Ϊ______ �� ���д˲������������л����е���Ҫ����������ˮ���ڲ�����ʹ�ø�����������£���ȥˮ����____________�ķ�����
(5)��ʵ��������������Ϊ6.0g���Ҵ�����Ϊ5.0g���õ������IJ�Ʒ����Ϊ4.4g�������������IJ�����_______��
(6)�Ҷ�����Ҷ���Ҳ�ܷ���������Ӧ��д�����ɻ����Ļ�ѧ��Ӧ����ʽ____________________��
����Ŀ��I�������£�HNO2���뷴Ӧ��ƽ�ⳣ��ֵΪ2.6��10-4��NaNO2��һ����Ҫ��ʳƷ���Ӽ�����������ۼ�ζ������ʳ�ηdz����ƣ���ʳ��ҵ�������ʳ���ж����¼�ʱ�з�����
��1��ij�С��ͬѧ���ʵ�鷽������ NaCl��Һ��NaNO2��Һ������д���б���
ѡ��ҩƷ | ʵ������ | ����NaNO2������ |
�ٷ�̪��Һ | ____________ | ____________ |
�ڵ���-KI��ֽ | ____________ | ____________ |
��2�����������ж������������ŷţ�ʵ����һ�㽫���뱥���Ȼ����Һ����ʹ֮ת���������������ʣ������֮һΪ��ɫ��ζ���壬�������Ϊ____________���ѧʽ����
II���С��ͬѧ��������װ���Ʊ����ⶨ���ù������������ƣ�NaNO2��������������װ�ÿ��ظ�ʹ�ã����ּг�������ʡ�ԣ���
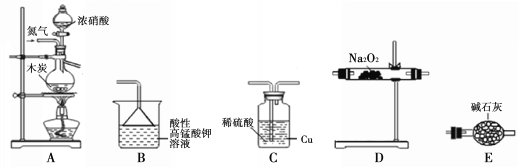
��֪�� ��2NO + Na2O2 ��2NaNO2��
�����������£�NO��NO2������MnO4����Ӧ����NO3����Mn2+��NaNO2��ʹ
���Ը��������Һ��ɫ��
��1��ʵ��װ�õ�����˳��Ϊ____________��
��2��Cƿ�ڷ�����Ӧ�����ӷ���ʽΪ____________��
��3��Ϊ�˲ⶨ�������Ƶĺ�������ȡ4.0g��Ʒ����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.10 mol��L��1������KMnO4��Һ���еζ���ʵ�������������±���
����� | 1 | 2 | 3 | 4 |
KMnO4��Һ���/mL | 20.60 | 20.02 | 20.00 | 19.98 |
�ٵ�һ��ʵ�����ݳ��ֽ������쳣������쳣��ԭ�������__________������ĸ��ţ���
a����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
b����ƿ������ˮϴ����δ����
c���۲�ζ��յ�ʱ���Ӷ���
�ڸ��ݱ������ݽ��м��㣬���ƵõĹ������������Ƶ���������Ϊ____________��
��4�����ʵ�飬�Ƚ�0.1mol��L��1NaNO2��Һ��NO2����ˮ��̶Ⱥ�0.1mol��L��1HNO2��Һ��HNO2����̶ȵ���Դ�С_______����Ҫ˵��ʵ�鲽�衢����ͽ��ۣ�������ҩƷ��ѡ����