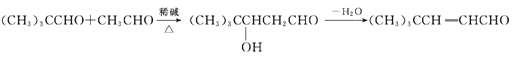题目内容
【题目】将2.3g金属Na投入一定质量的水中,会发生剧烈反应:2Na+2H2O===2NaOH+H2↑,
(1)反应产生标况下H2体积为多少?_________
(2)要使每10个H2O中含一个Na+,所需水的质量为多少?_____
(3)上述所得溶液密度为1.20g/mL,求溶液中NaOH的质量分数和物质的量浓度各为多少?(要求写出计算过程)__________
【答案】1.12L 19.8g 18.2% 5.46mol/L
【解析】
根据化学方程式中物质的计量关系,进行简单计算。
2Na + 2H2O = 2NaOH + H2↑
46g 2mol 2mol 22.4L
2.3g n(H2O) n(NaOH) V(H2)
(1)46g:2.3g=22.4L:V(H2),V(H2)=1.12L
(2)46g:2.3g=2mol:n(H2O),n(H2O)=0.1mol
反应后溶剂水n,(H2O)=![]() =1mol
=1mol
共需水质量m(H2O)=(0.1mol+1mol)×18g/mol=19.8g
(3)46g:2.3g=2mol:n(NaOH),n(NaOH)=0.1mol ,m(NaOH)=4.0g
反应后溶液质量m=2.3g+19.8g-0.1g=22g,溶液体积V=22g÷1.20g/mL=18.3mL
溶质质量分数=![]() =18.2%
=18.2%
溶质的物质的量浓度=![]() =5.46mol/L
=5.46mol/L

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目