题目内容
【题目】(题文)含碳物质在日常生活与工业生产上有广泛的应用。
(1)一种熔融碳酸盐燃料电池原理示意如图1所示,写出电极A中发生的电极方程式_____;

(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2。在15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为______________(填序号)。

(3)以 TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。乙酸的生成速率主要取决于温度影响的范围是______________________;
(4)CO和H2在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)获得甲醇。向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应合成甲醇,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图4所示。
CH3OH(g)获得甲醇。向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应合成甲醇,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图4所示。
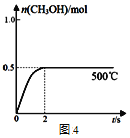
①500℃的此反应的平衡常数K=________________;
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,原因是________________(用化学方程式表示)。
③在500℃恒压条件下,请在图4中画出反应体系中n(CH3OH)随时间t变化的总趋势图________________。
【答案】H2-2e-+CO32-=CO2+H2O、CO-2e-+CO32-=2CO2Ⅱ>Ⅲ>Ⅰ300℃<T<400℃4Cu2O+CO![]() 2Cu+CO2
2Cu+CO2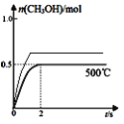
【解析】
(1)燃料电池工作时,通入燃料的为负极,即CO和H2在负极失去电子发生氧化反应,电极反应为:H2-2e-+CO32-=CO2+H2O、CO-2e-+CO32-=2CO2,故答案为:H2-2e-+CO32-=CO2+H2O、CO-2e-+CO32-=2CO2;
(2)由图2可知,在0~15h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅲ)<△n(Ⅱ),故在0~15h内,CH4的平均生成速率Ⅱ>Ⅲ>Ⅰ,故答案为:Ⅱ>Ⅲ>Ⅰ;
(3)根据图像,温度超过250℃时,催化剂的催化效率降低,在300℃时失去活性,故以后乙酸的生成速率升高是由温度升高导致的,故乙酸主要取决于温度影响的范围为300℃~400℃,故答案为:300℃~400℃;
(4)①根据图像,2s后达到平衡,平衡时甲醇的物质的量为0.5mol,浓度为0.25mol/L,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol/L) 0.5 1 0
反应(mol/L)0.25 0.5 0.25
平衡(mol/L)0.25 0.5 0.25
500℃的此反应的平衡常数K=![]() =
=![]() =4,故答案为:4;
=4,故答案为:4;
②在加热条件下CO能还原Cu2O使其减少,因此反应体系中含有少量二氧化有利于抑制反应向正反应方向移动,维持Cu2O的量不变,反应方程式为Cu2O+CO2Cu+CO2,故答案为:Cu2O+CO2Cu+CO2;
③合成甲醇:CO(g)+2H2(g)CH3OH(g),反应后气体体积减小,在500℃恒压条件下,容器体积减小压强增大,相当于增大了压强,反应速率加快,达到平衡需要的时间减少,增大压强,平衡正向移动,甲醇的物质的量增大,图像为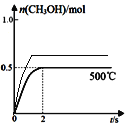 ;故答案为:
;故答案为: ;
;

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案