题目内容
【题目】某小组同学欲探究H2O2的性质,经历如下探究过程:
预测:聚焦H2O2中的O作为核心元素,因此预测H2O2既具有氧化性,也具有还原性。
(1)预测其具有氧化性的思路是_________。
实验和观察:小组同学分别选用酸性KMnO4溶液、酸化的KI溶液与5% H2O2溶液反应以验证预测。
实验① 实验②
实验②
(2)实验①利用了酸性高锰酸钾的_________ 性质,该实验中,证明KMnO4溶液与H2O2反应的现象除了溶液颜色变浅或褪色外,还有________。
(3)实验②是为了验证H2O2的_________ 性质,在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式____________。
解释和结论:
(4)以上实验可得出的结论是______________________ 。
【答案】H2O2中的O为-1价,可能降低为-2价,因此H2O2可能具有氧化性 氧化 有气体产生 氧化 2I-+H2O2+2H+= I2+2H2O H2O2既具有氧化性,也具有还原性
【解析】
(1)在化学反应中,化合价降低得电子的物质做氧化剂,具有氧化性,H2O2中的O为-1价,处于中间价态,即双氧水中的氧元素的化合价可降低显示氧化性;
(2)实验①利用酸性高锰酸钾具有强氧化性,与双氧水发生氧化还原反应,双氧水做还原剂,氧元素的化合价升高变为氧气,该反应现象为紫色高锰酸钾溶液褪色,同时有气体放出;
(3)实验②利用了碘化钾中碘为-1价,为碘元素的最低价态,具有还原性,验证双氧水具有氧化性,反应后的溶液中加入淀粉变蓝,说明碘化钾与双氧水发生氧化还原反应生成碘单质;
(4)实验①证明双氧水具有还原性,实验②证明双氧水具有氧化性,则结合上述实验得到最终结论。
(1)在化学反应中,化合价降低得电子的物质做氧化剂,具有氧化性,H2O2中的O为-1价,处于中间价态,氧元素的化合价可以升高,也可以降低,即双氧水中的氧元素的化合价可降低显示氧化性,故答案为:2O2中的O为-1价,可能降低为-2价,因此H2O2可能具有氧化性;
(2)实验①利用酸性高锰酸钾具有强氧化性,与双氧水发生氧化还原反应,双氧水做还原剂,氧元素的化合价升高变为氧气,该反应现象为紫色高锰酸钾溶液褪色,同时有气体放出,故答案为:氧化;有气体产生;
(3)实验②利用了碘化钾中碘为-1价,为碘元素的最低价态,具有还原性,验证双氧水具有氧化性,反应后的溶液中加入淀粉变蓝,说明碘化钾与双氧水发生氧化还原反应生成碘单质,发生的离子反应为:2I-+H2O2+2H+= I2+2H2O,故答案为:氧化;2I-+H2O2+2H+= I2+2H2O;
(4)实验①证明双氧水具有还原性,实验②证明双氧水具有氧化性,则结合上述实验得到最终结论:H2O2既具有氧化性,也具有还原性,故答案为:H2O2既具有氧化性,也具有还原性。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K=![]() ,它所对应的化学反应为:________________。
,它所对应的化学反应为:________________。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3 kJ/mol
CO2(g)+H2(g) △H=-41.3 kJ/mol
总反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) 的△H =____________;二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为________________。
CH3OCH3(g)+CO2(g) 的△H =____________;二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为 0.020 mol/L,在该条件下,CO的平衡转化率为:________________。
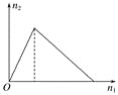
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如 NO、NO2、N2O4等,对反应N2O4(g)![]() 2NO2(g) △H >0,在温度为 T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是________________。
2NO2(g) △H >0,在温度为 T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是________________。
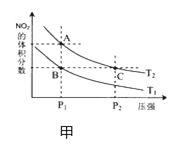
A. A、C 两点的反应速率:A>C
B. A、C 两点气体的颜色:A 深,C浅
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态 B 到状态 A,可以用加热的方法
E. A、C 两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3,25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加 n L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(NH3·H2O的电离平衡常数取Kb=2×10﹣5 mol/L)。
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图乙所示,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触。
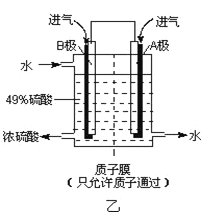
①溶液中H+的移动方向由________极到________极;(用 A、B 表示)
②B电极的电极反应式为____________。