题目内容
用零价铁(Fe)进行水体脱氮、(去除水体中的NO3-),已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。其中作负极的物质是________,正极的电极反应式是_________。

(2)研究表明,零价铁脱氮后最终会在表面生成不导电的FeO(OH)外皮,从而使得脱氮过程停止。补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ. Fe2+破坏FeO(OH)氧化层。
针对假设I:做对比实验,结果如图所示,可得到的结论是_______。
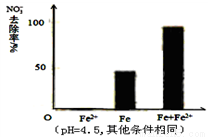
②针对假设II:以同位素示踪法,证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为_______________,加入Fe2+提高NO3-去除率的原因:____________。
(3)将足量铁粉投入水体中,测定不同初始pH对脱氧的影响见下边左图,初始PH为2.5时氮浓度与pH变化见下边图。结合两图分析,不同初始pH对脱氮产生影响的原因为_________________。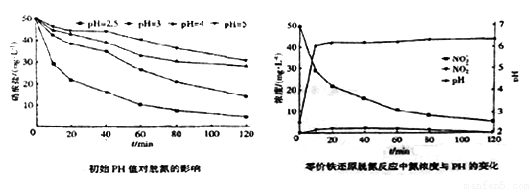
 习题精选系列答案
习题精选系列答案已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中正确的是
A. 容器①中反应达平衡时,CO的转化率为80%
B. 平衡时,若向容器①中再加入0.2molCO和0.2molCO2,则V正<V逆
C. Q=8.2
D. 容器①中CO的转化率与容器②中CO2的转化率之和为1
甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是
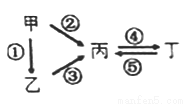
选项 | 甲 | 乙 | 丙 | 丁 |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | S | H2S | SO3 | H2SO4 |
C | N2 | NH3 | NO | NO2 |
D | Si | SiO2 | Na2SiO3 | Na2CO3 |
A. A B. B C. C D. D


 H2(g)+I2(g) 达到平衡时,欲使混合气体的颜色加深,采取的措施不能达到此目的是( )
H2(g)+I2(g) 达到平衡时,欲使混合气体的颜色加深,采取的措施不能达到此目的是( ) CH3CHBr2
CH3CHBr2 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O 2CO2+3H2O
2CO2+3H2O