题目内容
12.能说明可逆反应H2(g)+I2(g)═2HI(g)达到平衡状态的是( )| A. | 混合气体密度恒定不变 | B. | 混合气体的颜色不再改变 | ||
| C. | 混合气体的平均摩尔质量恒定不变 | D. | H2、I2、HI的浓度相等 |
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:A.反应前后气体的体积不变,混合气体的质量始终不变,所以密度始终不变,故混合气体的密度不随时间改变不能作为判断是否达到化学平衡状态的依据,故A错误;
B.HI和氢气为无色气体,碘蒸气为紫红色气体,故混合气体的颜色不变可作为判断是否达到平衡状态的依据,故B正确;
C.混合气体的质量不变,物质的量不变,混合气体的平均摩尔质量恒定不变,所以混合气体的平均摩尔质量恒定不变不能作为判断是否达到化学平衡状态的依据,故C错误;
D.平衡时各物质的浓度取决于物质的起始物质的量和转化率,故H2、I2、HI的浓度相等不能作为判断是否达到平衡状态的依据,故D错误;
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大.注意化学平衡状态的根本标志是:①v(正) =v(逆),②各组分百分含量不变;在解题时要牢牢抓住这两个根本标志,并明确气体的颜色、密度、压强、平均相对分子质量的变化与根本标志的关系,才能全面分析、正确作答.

练习册系列答案
相关题目
3.高铁电池是一种新型可充电碱性电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A. | 放电时负极反应式为:Zn-2e-=Zn2+ | |
| B. | 放电时每转移3mol电子,正极有2 mol K2FeO4被还原 | |
| C. | 放电时正极反应式为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- | |
| D. | 放电时正极附近溶液的碱性减弱 |
17.常温下,下列各组离子在指定的溶液中一定能大量共存的是( )
| A. | pH>7的溶液中:Na+、K+、SO${\;}_{3}^{2-}$、CO${\;}_{3}^{2-}$ | |
| B. | 无色透明溶液中:H+、Ca2+、Cl-、AlO2- | |
| C. | 含大量Fe3+的溶液中:K+、I-、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| D. | 与Al反应放出H2的溶液中:NH${\;}_{4}^{+}$、Na+、NO${\;}_{3}^{-}$、F- |
4.下列有关物质的性质和用途的说法正确,且存在因果关系的是( )
| A. | 碳酸钠能和酸反应,可用碳酸钠治疗胃酸过多 | |
| B. | 氧化铁能与酸反应,可用于制作红色涂料 | |
| C. | MgO、Al2O3熔点高,可用于制作耐火材料 | |
| D. | 明矾具有强氧化性,常用于自来水的杀菌消毒 |


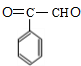 +2H2$\stackrel{一定条件}{→}$
+2H2$\stackrel{一定条件}{→}$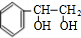 .
.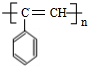 ,
,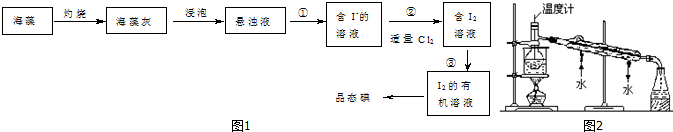 (1)指出提取的过程中有关实验操作名称:①过滤;③萃取、分液;
(1)指出提取的过程中有关实验操作名称:①过滤;③萃取、分液;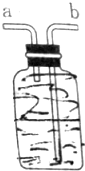 如图所示装置,用排空气法收集O2,O2应由b(填“a”或“b”下同)口进入,检验O2是否收集满的操作是将带火星的木条靠近a,如果带火星木条复燃,证明氧气收集满;若想用排水法收集O2,可将装置中充满水,O2由a口进入.
如图所示装置,用排空气法收集O2,O2应由b(填“a”或“b”下同)口进入,检验O2是否收集满的操作是将带火星的木条靠近a,如果带火星木条复燃,证明氧气收集满;若想用排水法收集O2,可将装置中充满水,O2由a口进入.