题目内容
17.常温下,下列各组离子在指定的溶液中一定能大量共存的是( )| A. | pH>7的溶液中:Na+、K+、SO${\;}_{3}^{2-}$、CO${\;}_{3}^{2-}$ | |
| B. | 无色透明溶液中:H+、Ca2+、Cl-、AlO2- | |
| C. | 含大量Fe3+的溶液中:K+、I-、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| D. | 与Al反应放出H2的溶液中:NH${\;}_{4}^{+}$、Na+、NO${\;}_{3}^{-}$、F- |
分析 A.pH>7的溶液,显碱性;
B.偏铝酸根离子不能存在于碱性溶液中;
C.离子之间发生氧化还原反应;
D.与Al反应放出H2的溶液,为非氧化性酸或强碱溶液.
解答 解:A.pH>7的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.H+、AlO2-反应生成沉淀或铝离子,则不能大量共存,故B错误;
C.Fe3+、I-发生氧化还原反应,不能大量共存,故C错误;
D.与Al反应放出H2的溶液,为非氧化性酸或强碱溶液,酸性溶液中不能大量存在F-,碱性溶液中不能大量存在NH4+,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| B. | 饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释 | |
| C. | 在$\frac{{c({H^+})}}{{c(O{H^-})}}$=10-12.溶液中Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极 |
12.能说明可逆反应H2(g)+I2(g)═2HI(g)达到平衡状态的是( )
| A. | 混合气体密度恒定不变 | B. | 混合气体的颜色不再改变 | ||
| C. | 混合气体的平均摩尔质量恒定不变 | D. | H2、I2、HI的浓度相等 |
2.下列说法正确的是( )
| A. | 晶体中含有金属阳离子,说明该物质一定是离子晶体 | |
| B. | SiO2既能溶于NaOH溶液又能溶于HF,说明SiO2是两性氧化物 | |
| C. | 高分子分离膜可使海水淡化,说明该过程发生了化学变化 | |
| D. | 一束光射入蛋白质溶液中可以看到一条光亮的通路,说明蛋白质溶液属于胶体 |
9.某合作学习小组讨论辨析以下说法正确的是( )
①粗盐和酸雨都是混合物 ②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物 ④不锈钢和目前流通的硬币都是合金
⑤盐酸和食醋既是化合物又是酸 ⑥纯碱和熟石灰都是碱 ⑦利用丁达尔效应可以区分溶液和胶体.
①粗盐和酸雨都是混合物 ②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物 ④不锈钢和目前流通的硬币都是合金
⑤盐酸和食醋既是化合物又是酸 ⑥纯碱和熟石灰都是碱 ⑦利用丁达尔效应可以区分溶液和胶体.
| A. | ①②③④⑥ | B. | ①③④⑦ | C. | ③④⑤⑥⑦ | D. | ①②④⑤ |
6.通常要用氧化剂才能实现的反应是( )
| A. | NaCl→HCl | B. | Cl2→HCl | C. | Cl-→Cl2 | D. | ClO3-→Cl2 |
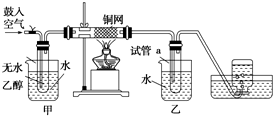 某实验如图.
某实验如图.