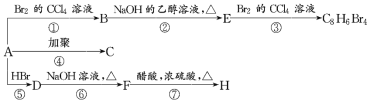
题目内容
【题目】[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
【答案】(1)[Ar]3d9;N>O>S;(2)正四面体,CCl4(或SiF4等);(3)sp2,配位键、离子键;(4)CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;(5)①(![]() ;
;![]() ;
;![]() ),Cu;②
),Cu;②![]() 。
。
【解析】
试题分析:(1)阳离子是Cu2+,Cu元素位于第四周期IB族,元素基态原子核外电子排布式为[Ar]3d104s1,因此Cu2+基态核外电子排布式为:[Ar]3d9;同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,非金属性越强,第一电离能越大,即第一电离能大小顺序是N>O>S;(2)SO42-价层电子对数为SO42-价层电子对数为为4+(6+2-4×2)/20=4,因此SO42-立体结构是正四面体,等电子体:价电子总数相等,原子总数相等的微粒,因此S符合条件的是CCl4或SiF4等;(3)NO3-中N有3个σ键,孤电子对数(5+1-2×3)/2=0,杂化类型等于价层电子对数,即N的杂化类型为sp2,含有化学键为离子键、配位键;(4) CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;(5)①根据各个原子的相对位置可知,D在各个方向的1/4处,所以其坐标是(![]() ;
;![]() ;
;![]() ),根据均摊法,白球的个数为(8×1/8+1)=2,灰球位于体心,灰球有4个,因此化学式为Cu2O,灰球是Cu;②晶胞质量为2×144/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义,阿伏加德罗常数=
),根据均摊法,白球的个数为(8×1/8+1)=2,灰球位于体心,灰球有4个,因此化学式为Cu2O,灰球是Cu;②晶胞质量为2×144/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义,阿伏加德罗常数=![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是( )
A. 实验时的温度T2高于T1
B. 2号Cu2O的催化效率比1号Cu2O的催化效率高
C. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1
D. 等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关