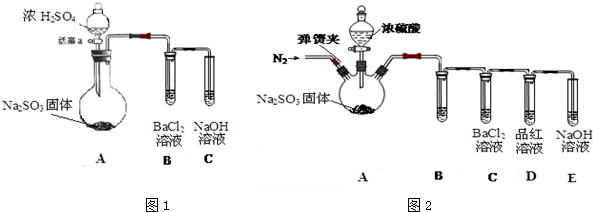
题目内容
11.镁在工农业生产中有非常广泛的应用.(1)工业上常用电解熔融MgCl2制备金属镁,而MgCl2的获得主要有两种方法:
方法一:从海水或光卤石中先获得MgCl2•6H2O,然后制得无水MgCl2.
方法二:MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑;MgO+C+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2+CO.
则在“方法一”中,从MgCl2•6H2O制无水MgCl2操作时应在HCl气体保护下进行.在“方法二”中,MgO和C否(填“能”或“否”)直接反应生成金属镁.
(2)镁电池在性能上优于其他电池,具有更安全、环保、能效高等优点.有一种镁电池的反应为Mg+2CuCl═2Cu+MgCl2,又知CuCl难溶于水,则该电池的正极反应式是2CuCl+2e-═2Cu+2Cl-.
(3)化合物MgSO4在医疗上具有镇静、抗痉挛等功效.有一种以菱镁矿(主要成分是MgCO3)为主要原料制备MgSO4的方法如下:

步骤②中发生反应的离子方程式为2NH4++MgO═Mg2++2NH3↑+H2O.
步骤④中调节pH=6.0~6.5的目的是抑制Mg2+水解,为了得到较纯的产品.对MgSO4•7H2O晶体直接加热能(填“能”或“不能”)得到无水MgSO4固体?
分析 (1)从MgCl2•6H2O制无水MgCl2时加热会促进镁离子的水解生成氢氧化镁和氯化氢,加入HCl气体,抑制水解;镁很活泼,在加热条件下会与空气中的氧气和二氧化碳反应,不能用镁和碳直接反应得到镁;
(2)镁电池属于原电池,正极CuCl得电子生成Cu;
(3)步骤②中发生反应的为硫酸铵和氧化镁反应生成氨气、硫酸镁和水,步骤④中将硫酸镁溶液蒸发、结晶时,调节pH为弱酸性,抑制镁离子的水解;将MgSO4•7H2O晶体直接加热,硫酸镁较稳定,结晶水脱去,硫酸镁可以稳定存在.
解答 解:(1)从MgCl2•6H2O制无水MgCl2操作时 需要加热,加热会促进镁离子的水解生成氢氧化镁和氯化氢,为了防止水解,加入HCl气体,使水解平衡逆向移动,抑制水解;镁很活泼,在加热条件下会与空气中的氧气和二氧化碳反应,回到氧化镁,所以不能用镁和碳直接反应得到镁,
故答案为:HCl气体;否;
(2)镁电池属于原电池,正极得电子,是还原反应,Mg+2CuCl═2Cu+MgCl2 中得电子的是CuCl生成Cu,
故答案为:2CuCl+2e-═2Cu+2Cl-;
(3)步骤②中发生反应的为硫酸铵和氧化镁反应生成氨气、硫酸镁和水,改写成离子方程式为 2NH4++MgO═Mg2++2NH3↑+H2O;
步骤④中将硫酸镁溶液蒸发、结晶时,为了抑制镁离子的水解,调节pH为弱酸性,使镁离子的水解平衡逆向移动,得到纯净的硫酸镁晶体;
将MgSO4•7H2O晶体直接加热会造成结晶水脱去,硫酸镁较稳定,可以稳定存在.
故答案为:2NH4++MgO═Mg2++2NH3↑+H2O;抑制Mg2+水解,为了得到较纯的产品;能.
点评 本题考查了原电池电极反应方程式的书写、镁及其化合物的性质,盐类水解等知识点,中等难度,答题时注意化学原理的基础知识的灵活运用.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2=-192.9kJ•mol-1
下列说法正确的是( )
| A. | 上述图示的反应为吸热反应 | |
| B. | 图中的能量变化如图所示,则△H=E1-E3 | |
| C. | H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 | |
| D. | 根据①②推知:在25℃、101 kPa时,1 mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于676.7 kJ |
| A. | 氯气工厂爆炸时可用湿布捂住鼻孔、眼睛等并躲在下风的低洼处 | |
| B. | 二氧化硫可用来加工食品,使食品增白 | |
| C. | 锂可用于制造质量轻、电容量大的可充电电池 | |
| D. | 高纯度二氧化硅是制造太阳能电板的材料之一 |
| A. | 28g/mol | B. | 56g/mol | C. | 84g | D. | 112 |
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 6:1 |

 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
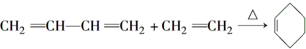
 .
.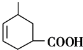 ,G中官能团的名称为羧基和碳碳双键.
,G中官能团的名称为羧基和碳碳双键.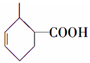 .
.