题目内容
利用100mL0.50 mol·L-1 Na2CO3溶液配制Na+浓度为0.20 mol·L-1的溶液,下列操作正确的是
| A.将该Na2CO3溶液转移至250mL容量瓶中,加蒸馏水稀释至刻度线,摇匀 |
| B.将该Na2CO3溶液转移至250mL烧杯中,用量筒量取150mL蒸馏水加入,搅拌 |
| C.将该Na2CO3溶液转移至500mL烧杯中,用量筒量取400mL蒸馏水加入,搅拌 |
| D.将该Na2CO3溶液转移至500mL容量瓶中,加蒸馏水稀释至刻度线,摇匀 |
D
根据碳酸钠的化学式可知,稀释后碳酸钠的浓度是0.1mol/L,所以稀释后碳酸钠溶液的体积是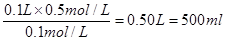 。配制需要500ml容量瓶,所以只有选项D正确,其余都是错误的,答案选D。
。配制需要500ml容量瓶,所以只有选项D正确,其余都是错误的,答案选D。
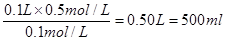 。配制需要500ml容量瓶,所以只有选项D正确,其余都是错误的,答案选D。
。配制需要500ml容量瓶,所以只有选项D正确,其余都是错误的,答案选D。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2NH3的平衡,每有17gNH3生成,必有0.5NA个NH3分子分解
2NH3的平衡,每有17gNH3生成,必有0.5NA个NH3分子分解