题目内容
在进行胃部透视时,为取得良好的检查效果,需要在检查之前服用“钡餐”,“钡餐”的主要成分是硫酸钡。在 25℃时,1L水中约能溶解2.4×10-3g硫酸钡,它的溶度积常数Ksp=1.1×10 -10。
(1)钡离子是一种有毒的重金属离子,当人体中钡离子浓度达到2×10-3 mol.L-1时,就会对健康产生危害。 请通过计算说明为什么可以用硫酸钡作为“钡餐”。
(2)在25℃时,1L水中约能溶解0.018g碳酸钡,且胃液是酸性的,能否用碳酸钡代替硫酸钡作为“钡餐”的主要成分?
(1)钡离子是一种有毒的重金属离子,当人体中钡离子浓度达到2×10-3 mol.L-1时,就会对健康产生危害。 请通过计算说明为什么可以用硫酸钡作为“钡餐”。
(2)在25℃时,1L水中约能溶解0.018g碳酸钡,且胃液是酸性的,能否用碳酸钡代替硫酸钡作为“钡餐”的主要成分?
(1)BaSO4 (s) Ba2+ (aq)+SO42- (aq)
Ba2+ (aq)+SO42- (aq)
Ksp=c(Ba2+)·c(SO42-)
C2(Ba2+)=1.1×10-10 ,c(Ba2+) =1. 05×10-5 mol.·L-1<2 ×10-3 mol·L-1,
SO42-是强酸酸根离子,在溶液中它难以与H+ 结合成硫酸,因此胃液中H+对BaSO4的沉淀溶解平衡基本没有影响,Ba2+浓度可以保持在安全浓度标准以下,因此BaSO4可用做“钡餐”。
(2)BaCO3 (s)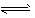 Ba2+ (aq)+CO32- (aq),由于胃液是酸性的,如果服下BaCO3,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,Q<Ksp,从而使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。
Ba2+ (aq)+CO32- (aq),由于胃液是酸性的,如果服下BaCO3,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,Q<Ksp,从而使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
 Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)