题目内容
【题目】在一定温度下,盛有催化剂的体积一定的密闭容器中,通入一定量的SO3气体,发生分解反应2SO32SO2+O2 , 并达到平衡状态,测得SO3的分解率为75%.下列说法正确的是( )
A.平衡后的压强为起始压强的1.25倍
B.平衡时混合气体的平均相对分子质量为64
C.混合气体的密度自始至终保持不变
D.取和SO3等质量的SO2和O2的混合气体,从逆反应开始并达到平衡,在相同条件下各物质的浓度与原来的平衡浓度一定相等
【答案】C
【解析】解:设SO3的物质的量为1mol,发生分解反应2SO32SO2+O2,并达到平衡状态,测得SO3的分解率为75%,则分解的SO3的物质的量为0.75mol,则
2SO3 | 2SO2+ | O2 | |
起始(mol) | 1 | 0 | 0 |
转化(mol) | 0.75 | 0.75 | 0.375 |
平衡(mol) | 0.25 | 0.75 | 0.375 |
A.等温等体积时压强之比等于物质的量之比,平衡后的压强为起始压强的 ![]() =1.375倍,故A错误;
=1.375倍,故A错误;
B.1molSO3的质量为80g,平衡时混合气体的平均相对分子质量为 ![]() =58.2,故B错误;
=58.2,故B错误;
C.由于气体的质量和容器的体积不变,则气体的密度不变,故C正确;
D.取和SO3等质量的SO2和O2的混合气体,如SO2和O2的物质的量之比不能满足2:1,则不是等效平衡,不能达到相同的平衡状态,故D错误.
故选C.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.

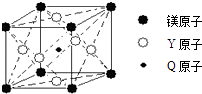
【题目】Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
元素 | 相关信息 |
Q | Q的单质是实验室常用的惰性电极材料 |
R | R原子基态时2p原子轨道上有3个未成对电子 |
T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
X | X是第三周期电负性最大的元素 |
Y | 元素Y位于周期表第10列 |
Z | Z存在质量数为65,中子数为36的核素 |
(1)Z元素的原子基态时的电子排布式是
(2)下列叙述正确的是 a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2 . QT分子中σ键π键的个数比为;QT2分子中,Q原子采取杂化.
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构.故的空间构型为 , 且为(填“极性”或“非极性”)分子.
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如图所示.该晶体的化学式为;晶体中每个镁原子周围距离相等且最近的Y原子有个.