题目内容
【题目】已知合成氨反应N2(g)+3H2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a、b、c如图所示.下列说法正确的是( )
A.曲线a对应的反应温度最高
B.上图中M、N、Q点平衡常数K的大小关系为K(M)=K(Q)<K(N)
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
D.N点时c(NH3)=0.2mol/L,则N点的c(N2):c(NH3)=1:1
【答案】D
【解析】A、正反应是放热反应,升高温度平衡逆向移动,氨气的含量减小,而a点氨的体积分数最大,所以曲线a对应的反应温度最低,故A错误;
B、K只受温度影响,温度不变平衡常数不变,所以K(M)=K(Q),正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,Q点的温度低于N,所以K(Q)>K(N),故B错误;
C、相同压强下,投料相同,温度越高反应速率越快,达到平衡消耗时间越短,cba的温度依次降低,所以达到平衡消耗时间关系为a>b>c,故C错误;
D、N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a﹣ab 3a﹣3ab 2ab
根据题意有 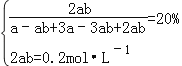 ,所以a=0.3molL﹣1 , b=
,所以a=0.3molL﹣1 , b= ![]() ,则N点的c(N2):c(NH3)=(0.3﹣0.3×
,则N点的c(N2):c(NH3)=(0.3﹣0.3× ![]() ):2×0.3×
):2×0.3× ![]() =0.2:0.2=1:1,故D正确;
=0.2:0.2=1:1,故D正确;
故选:D.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 阅读快车系列答案
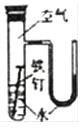
阅读快车系列答案【题目】下列实验的有关叙述错误的是( )
选项 | A | B | C | D |
实验装置图 |
|
|
|
|
实验现象 | U形管右侧液面下降 | 小试管中品红溶液褪色 | 加入少量酚酞,溶液变浅红色 | 关闭弹簧夹,双手捂住圆底烧瓶,导管中水柱上升后静止不动 |
实验结论 | 该条件下铁钉发生吸氧腐蚀 | 证明二氧化硫具有还原性 | 证明Na2CO3能够发生水解 | 该装置气密性良好 |
A.A
B.B
C.C
D.D