题目内容
某温度下,已知Ksp(AgCl)=1.56×10—10,Ksp(AgBr)=7.7×10—13,Ksp(Ag2CrO4)=9.0×10—12。某溶液中含有Cl—、Br—、CrO42—,浓度均为0.010 mol/L,向该溶液中逐滴加入0.010 mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.Cl—、Br—、CrO42— | B.CrO42—、Br—、Cl— |
| C.Br—、Cl—、CrO42— | D.Br—、CrO42—、Cl— |
C
解析试题分析:当 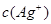 与
与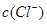 的积超过1.56×10—10有沉淀,当
的积超过1.56×10—10有沉淀,当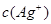 与
与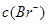 的积超过7.7×10—13,时有沉淀,当
的积超过7.7×10—13,时有沉淀,当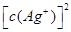 与
与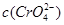 的积超过9.0×10—12时有沉淀,因为Cl—、Br—、CrO42—的浓度相等,所以产生沉淀的顺序为Br—、Cl—、CrO42—,故C正确。
的积超过9.0×10—12时有沉淀,因为Cl—、Br—、CrO42—的浓度相等,所以产生沉淀的顺序为Br—、Cl—、CrO42—,故C正确。
考点:考查Ksp。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
室温时,将x mL pH="a" 的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
| A.若x=y,且a+b=14,则pH>7 | B.若10x=y,且a+b=13,则pH=7 |
| C.若ax=by,且a+b=13,则pH=7 | D.若x=10y,且a+b=14,则pH>7 |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 moI/L NaOH溶液。有关微粒的物质的量变化如下图所示(其中I代表H2A,Ⅱ代表HAˉ,Ⅲ代表A2ˉ),根据图示判断,下列说法正确的是( )
| A.当V[NaOH(aq)] ="20" mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)>c(A2ˉ)>c(OHˉ) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为:H2A= HAˉ +H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少 |
有关常温下pH均为11的氨水和Ba(OH)2溶液的说法正确的是
| A.两溶液中,由水电离出的氢氧根离子浓度均为1×10-11mol/L |
| B.分别加水稀释100倍后,两种溶液的pH均变为9 |
| C.氨水中的c(NH+)和Ba(OH)2溶液中的c(Ba2+)相等 |
| D.分别加入等量的pH为1的硫酸,二者的导电能力均减小 |
下列关于盐酸与醋酸两种稀溶液的说法正确的是 ( )
| A.相同浓度的两溶液中c(H+)相同 |
| B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠 |
| C.pH=3的两溶液都稀释10倍,盐酸的pH大于醋酸的PH |
| D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小 |
将等物质的量浓度、等体积的硫酸与烧碱溶液混合后,滴入紫色石蕊试液,溶液呈( )
| A.紫色 | B.红色 | C.蓝色 | D.无色 |
下列说法正确的是
| A.pH<7的溶液一定是酸性溶液 |
| B.室温时,pH=5的溶液和pH=3的溶液相比,前者c(OH-)是后者的100倍 |
| C.室温下,每1×107个水分子中只有一个水分子发生电离 |
| D.HCl溶液中无OH-,NaOH溶液中无H+,NaCl溶液中既无OH-也无H+ |
甲酸(HCOOH)的下列性质中,可以证明它是弱电解质的是
| A.甲酸溶液中有大量的HCOOH分子和H+、HCOO— |
| B.甲酸能与水以任意比例互溶 |
| C.10mL 1 mol/L甲酸恰好与10mL 1 mol/LNaOH溶液完全反应 |
| D.在相同温度下,相同浓度的甲酸溶液的导电性比盐酸弱 |
99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是
| A.此时水的离子积Kw=1×10-12 | B.水电离出的c(H+)=1×10-12 mol/L |
| C.水的电离程度随温度升高而增大 | D.c(Na+)=c(SO42-) |