题目内容
13.自水常用氯气进行消毒.如果在实验室用自水配制下列物质的溶液,不会产生明显药品变质问题的是( )| A. | AgNO3 | B. | NaI | C. | NaOH | D. | AlCl3 |
分析 自来水中,氯气与水发生:Cl2+H2O?HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子,结合对应粒子的性质解答该题.
解答 解:A.氯水中含有Cl-,加入硝酸银生成氯化银沉淀,不能用于配制AgNO3溶液,故A错误;
B.Cl2、HClO具有强氧化性,可与NaI发生氧化还原反应,不能用于配制NaI溶液,故B错误;
C.氯水中氯气、HClO、H+都能与氢氧化钠反应,不能用于配制氢氧化钠溶液,故C错误;
D.氯水中各粒子与AlCl3都不反应,可用于配制AlCl3溶液,故D正确.
故选D.
点评 本题考查氯气的性质,侧重于氯水的成分与性质的考查,为高考高频考点,很好地考查学生的科学素养,能提高学生学习的积极性,难度不大,注意相关基础知识的积累,本题中要注意氯水的成分和性质.

练习册系列答案
相关题目
1.下列叙述正确的是( )
| A. | 1.00molNaCl中含有6.02×1023个NaCl分子 | |
| B. | 1.00molNaCl中,所有的Na+的最外层电子总数8×6.02×1023 | |
| C. | 欲配制1L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
8.25℃,向20mL 0.1mol•L-1的H3PO2溶液中滴加0.1mol•L-1的NaOH溶液(滴定过程中溶液温度保持不变),滴定曲线如图1,含磷物种浓度所占分数(δ)随pH变化关系如图2,则下列说法不正确的是( )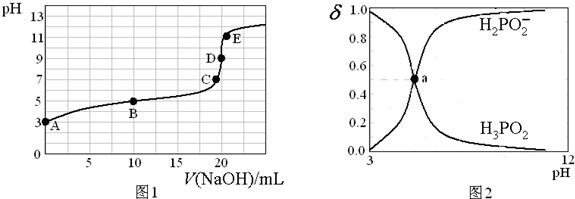

| A. | H3PO2的电离方程式为:H3PO2?H2PO2-+H+;电离常数Ka≈10-5 | |
| B. | B点溶液中存在关系:2c(H+)+c(H3PO2)=2c(OH-)+c(H2PO2-) | |
| C. | 图2中的a点对应为 图1中的B点 | |
| D. | D点时,溶液中微粒浓度大小关系为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+) |
18.下列各组物质间,不能发生反应的是( )
| A. | 高温下,二氧化硅与氧化钙 | B. | 常温下,硅与氢氟酸溶液 | ||
| C. | 高温下,二氧化硅与碳酸钠固体 | D. | 常温下,二氧化硅与浓硝酸 |
2.互为同分异构体的物质不可能( )
| A. | 具有相同的相对分子质量 | B. | 具有相同的分子式 | ||
| C. | 具有相同的组成元素 | D. | 具有相同的熔、沸点 |
 图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
 (填结构简式)
(填结构简式)
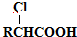 ,以物质C为原料制备聚乳酸(
,以物质C为原料制备聚乳酸(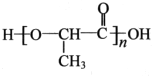 ),可通过四步反应制得,按反应顺序,这四步的反应类型依次是:氧化反应、取代反应、水解反应、缩聚反应.
),可通过四步反应制得,按反应顺序,这四步的反应类型依次是:氧化反应、取代反应、水解反应、缩聚反应.