题目内容
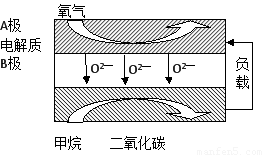
甲烷燃料电池的化学反应为CH4 + 2O2 = CO2 + 2H2O,其中1个电极反应式为2O2 + 8H4 + 8e- = 4H2O下列叙述不正确的是
- A.CH4通入负极
- B.O2通入正极
- C.正极发生氧化反应
- D.负极的电极反应式为:CH4 + 2H2O– 8e- = CO2 + 8H+
C
在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。甲烷在反应中失去电子,所以甲烷在负极通入,氧气在正极通入,发生还原反应,C不正确。总反应式减去正极反应式即得到负极反应式,D正确。答案选C。
在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。甲烷在反应中失去电子,所以甲烷在负极通入,氧气在正极通入,发生还原反应,C不正确。总反应式减去正极反应式即得到负极反应式,D正确。答案选C。

练习册系列答案
相关题目
合成氨联产二甲醚是一项具有中国特色的化工工艺,具有节能环保,其工艺流程如下:
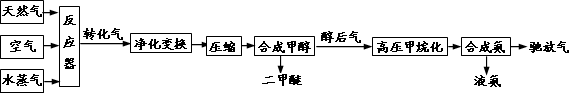
已知造气时,主要发生的反应有:CH4+H2O→CO+3H2………①;2CH4+O2→2CO+4H2………②.
CO、CO2均可与H2合成甲醇,合成甲醇后排出的醇后气中有很少量的CO、CO2,需与H2转化为甲烷,防止CO使合成氨催化剂中毒.
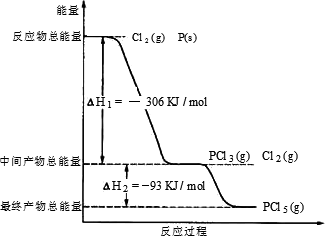
(1)已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1323 kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1;及CO的燃烧热:283 kJ·mol-1.
在一定条件下,CO、H2能生成二甲醚和气态水,该热化学方程式为________.(本题涉及的条件均在同一条件下)
(2)相同体积的天然气,采用“合成氨同时联产二甲醚”和直接合成氨相比,新工艺优越性有________.
a.减少二氧化硫排放
b.适应低碳经济
c.可提高氮肥产量
d.资源综合利用率和经济效益高
(3)下图为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为________.

(4)假定造气时产生的转化气中不含CO2,H2与CO物质的量之比为2.2,空气由80% N2和20% O2组成,天然气中CH4为100%,且①和②的转化率均为100%.则同温同压下通入的空气和水蒸气的体积比,V(空气)/V(水蒸气)=________.
(5)今有224 m3(已折合成标准状况)由CO、H2、N2组成的混合气体,分别合成甲醇和氨,且三种气体均完全转化,驰放气中甲烷忽略不计,若得到液氨34 kg,则同时得到二甲醚________千克?



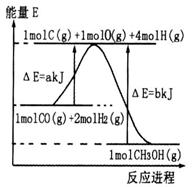 化碳体积比为__________。
化碳体积比为__________。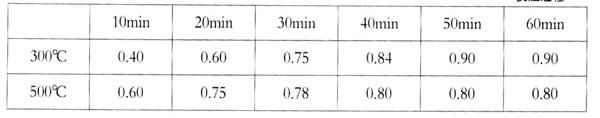 (表中数据单位:mol·L—1)
(表中数据单位:mol·L—1)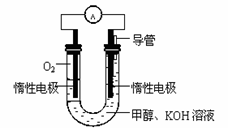 (3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示甲醇燃料电池, 该电池负极的电极反应式为 ;工作一段时间后,当9.6g甲醇完全反应时,有 NA个电子转移。
(3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示甲醇燃料电池, 该电池负极的电极反应式为 ;工作一段时间后,当9.6g甲醇完全反应时,有 NA个电子转移。