题目内容
Ⅰ.2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g) +N2(g) ,在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2CO2(g) +N2(g) ,在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。

据此判断:
(1)该反应的ΔH????? 0(选填“>”、“<”)。
(2)若在一定温度下,将1.0 mol NO、0.5 mol CO充入0.5 L固定容积的容器中,达到平衡时NO、CO、CO2、N2物质的量分别为:0.8 mol、0.3 mol、0.2 mol、0.1 mol,该反应的化学平衡常数为K=???????? ;若保持温度不变,再向容器中充入CO、N2各0.3 mol,平衡将????????? 移动(选填“向左”、“向右”或“不”)。
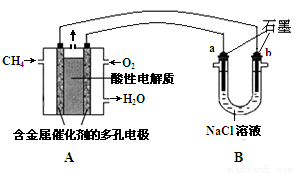
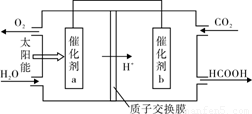
Ⅱ.以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

回答下列问题:
(1)B极为电池????? 极,电极反应式为????????????????????????????????????? 。
(2)若用该燃料电池做电源,用石墨做电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为???????? (标况下)。
Ⅲ.FeS饱和溶液中存在:FeS(s) Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为?????? 。
Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为?????? 。
I.(1)<(2分)
(2)k= 5/144 或0.0347? (2分)?? 不(2分)
II.(1) 负(2分)??? CH4 + 4O2——8e—= CO2+ 2H2O;(2分)?
(2) 1.12 L(2分,没有写单位得1分)???
III.3 (3分)
【解析】
试题分析:I.(1)结合图像分析,T1时先到达平衡,平衡时二氧化碳的浓度小,说明升高温度平衡左移,所以正反应为放热反应,ΔH<0;(2)化学平衡常数=生成物浓度的系数次方/反应物浓度的系数次方,所以k= 5/144 或0.0347;再向容器中充入CO、N2各0.3 mol时, Qc=k,平衡不移动。II.(1)燃料电池中负极通燃料,发生氧化反应,正极通氧气,发生还原反应。所以负极上甲烷失去电子结合氧离子形成二氧化碳和水,正极上氧气得到电子形成氧负离子。(2)用石墨做电极电解100 mL 1 mol/L的硫酸铜溶液时,阳极电极反应为:4OH——4e—= O2 + 2H2O;阴极先是:Cu2++2e— = Cu,然后是:2H++2e—= H2,设生成氧气amol,根据电子守恒可得:4a=0.1×2+2a, a=0.1mol。1molCH4转移电子8mol,所以消耗甲烷0.05mol;III.根据题目所给信息,c(Fe2+)达到1 mol/L时,c(S2-)= 1.0×10-16,因为[c(H+)]2·c(S2-)=1.0×10-22,所以c(H+)= 1.0×10-3,pH=3。
考点:考查化学平衡常数、化学平衡图像分析、燃料电池电极方程式的书写、电子守恒的应用、溶度积计算等知识。









 2CO2 (g) +N2 (g) 在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g) 在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断: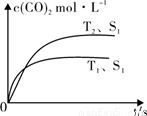
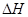 =-867kJ·mol-1
=-867kJ·mol-1 N2O4(g)
N2O4(g)
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0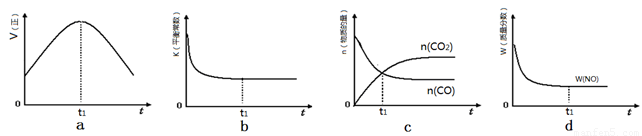
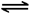 N2O4(g)
△H=-56.9 kJ/mol
N2O4(g)
△H=-56.9 kJ/mol