题目内容
17.下列有关溶液组成的描述合理的是( )| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、[Al(OH)4]? | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SCN? | |
| D. | 加入铝粉能放出氢气的溶液中能大量存在K+、Ba2+、Cl-、Br- |
分析 A.铝离子与[Al(OH)4]?发生双水解反应生成氢氧化铝沉淀;
B.酸性溶液中存在大量氢离子,次氯酸根离子能氧化碘离子、能够与氢离子结合生成次氯酸;
C.铁离子与硫氰根离子结合生成络合物硫氰化铁;
D.加入铝粉能放出氢气的溶液中存在大量氢离子或氢氧根离子,四种离子之间不反应,都不与氢离子和氢氧根离子反应.
解答 解:A.Al3+、[Al(OH)4]?之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.酸性溶液中存在大量氢离子,ClO?、I?之间发生氧化还原反应,ClO?与氢离子反应生成次氯酸,在溶液中不能大量共存,故B错误;
C.Fe3+、SCN?之间反应生成硫氰化铁,在溶液中不能大量共存,故C错误;
D.加入铝粉能放出氢气的溶液为酸性后强碱性溶液,K+、Ba2+、Cl-、Br-之间不反应,且都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.在温度不变,恒荣的容器中进行反应2A?B+C,若反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L需用时间可能为( )
| A. | 8s | B. | 10s | C. | 12s | D. | 14s |
8.某结晶水合物的化学式为R•nH2O,其相对分子质量为M.25℃时,将a g该晶体溶于b g水中恰好可形成V mL饱和溶液.下列关系正确的是( )
| A. | 饱和溶液的物质的量浓度c=$\frac{1000a(M-18n)}{MV}$mol/L | |
| B. | 饱和溶液中溶质的质量分数w=$\frac{a(M-18n)}{M(a+b)}$% | |
| C. | 25℃时R的溶解度S=$\frac{100a(M-18n)}{18na+Mb}$g | |
| D. | 饱和溶液的密度ρ=$\frac{a(M-18n)}{a+b}$g/L |
5.已知2H2(g)+O2(g)═2H2O(l)△H=-569.6kJ/mol,2H2O(g)═2H2(g)+O2(g)△H=+482.1kJ/mol.现有1g液态H2O,蒸发时吸收的热量是( )
| A. | 2.43 kJ | B. | 4.86 kJ | C. | 43.8 kJ | D. | 87.5 kJ |
12.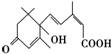 已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
 已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )| A. | S-诱抗素含有碳碳双键、羟基、羰基、羧基 | |
| B. | S-诱抗素分子式为C16H18O2 | |
| C. | S-诱抗素能发生加成反应、水解反应、氧化反应 | |
| D. | 1mol S-诱抗素在一定条件下可分别与4mol H2、2mol NaOH发生反应 |
2.下列物质属于共价化合物是( )
| A. | CaCl2 | B. | NaOH | C. | Na2O2 | D. | H2O2 |
6.下列各组物质混合反应后,既能生成气体,最终又能产生沉淀的是( )
①金属钠投入到FeCl3溶液中
②Na2O2投入到CuSO4溶液中
③电石投入到过量NaHCO3溶液中
④在过量明矾溶液加入少量的Na2O.
①金属钠投入到FeCl3溶液中
②Na2O2投入到CuSO4溶液中
③电石投入到过量NaHCO3溶液中
④在过量明矾溶液加入少量的Na2O.
| A. | 只有① | B. | 只有①② | C. | 除了③ | D. | 除了④ |
7.下列反应的离子方程式正确的是( )
| A. | 向碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 将少量二氧化碳通入水玻璃中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| D. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |