题目内容
【题目】氮氧化铝(AlON)具有多晶陶瓷在材料制备方面的优势,有着广阔的应用前景。工业上利用某铝土矿(含Al2O3及少量的MgO等杂质)生产氮氧化铝的流程如图所示。回答下列问题:
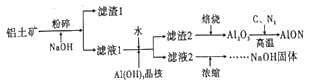
(1)为提高铝土矿碱浸的速率,除粉碎外,还可以采取的措施是_____(写出一项即可)
(2)滤液1的溶质有NaOH、_____。滤渣2的成分是_____。向滤液1中加水的目的是_______。该过程也可用通入足量的_____气体的方法来代替。
(3)滤液2浓缩的过程中常会吸收空气中的CO2,为得到纯净的NaOH,需要加入适量____(填化学式)。整个流程中,可循环的物质是_____。
(4)写出制备AlON的化学方程式_______。
(5)取1吨Al2O3质量分数为91.8%的铝土矿样品,利用上述流程AlON,最终制得氮氧化铝820.8kg,则氮氧化铝的产率为______。
【答案】升温 NaAlO2 Al(OH)3 促进NaAlO2的水解 CO2 Ca(OH)2 NaOH Al2O3+C+N2![]() 2AlON+CO 80%
2AlON+CO 80%
【解析】
(1)考查影响反应速率的因素,提高碱浸的速率,除粉碎外,还可以升高温度等;
答案为升高温度;
(2)铝土矿成分是Al2O3和MgO,其中MgO为碱性氧化物,不与NaOH反应,Al2O3为两性氧化物,发生Al2O3+2NaOH=2NaAlO2+H2O,为了让Al2O3充分反应,所加NaOH过量,即滤液1中溶质为NaOH和NaAlO2,滤渣1为MgO等不溶杂质;根据流程,滤渣2焙烧得到Al2O3,即滤渣2为Al(OH)3;根据流程,滤液2经过一系列变化后得到NaOH溶液,即滤液2中溶质主要是NaOH,即加水:NaAlO2+2H2O![]() Al(OH)3+NaOH,加水促进水解,因此加水的目的是促进NaAlO2的水解;利用碳酸的酸性强于Al(OH)3,以及Al(OH)3不溶于碳酸,因此该过程也可用足量的CO2气体来代替;
Al(OH)3+NaOH,加水促进水解,因此加水的目的是促进NaAlO2的水解;利用碳酸的酸性强于Al(OH)3,以及Al(OH)3不溶于碳酸,因此该过程也可用足量的CO2气体来代替;
答案是NaAlO2;Al(OH)3;促进NaAlO2的水解;CO2;
(3)NaOH溶液吸收空气中CO2,转化成Na2CO3,为了得到纯净的NaOH,需要除去CO32-,因此需要加入适量的Ca(OH)2,根据流程循环使用的物质是NaOH;
答案是Ca(OH)2;NaOH;
(4)根据流程,Al2O3与C、N2发生反应,高温下,C一般转化成CO,其反应方程式为Al2O3+C+N2![]() =2AlON+CO;
=2AlON+CO;
答案是Al2O3+C+N2![]() =2AlON+CO;
=2AlON+CO;
(5)利用铝原子守恒,理论上得到AlON的质量为![]() ,产率为
,产率为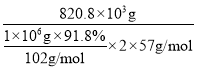 ×100%=80%;
×100%=80%;
答案是80%。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案