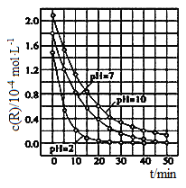
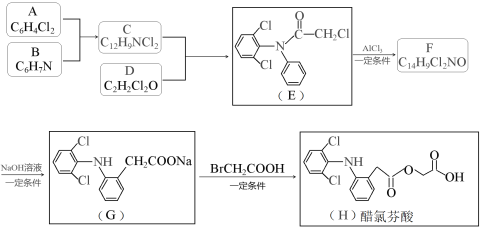
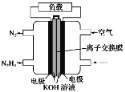
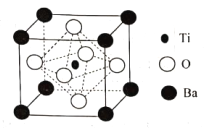
题目内容
【题目】在100mL某盐酸中加入混合均匀的NaHCO3和KHCO3固体粉末,充分反应后使气体全部逸出,加入固体与产生气体体积(标准状况下)的关系如下表:
固体质量/g | 11.25 | 45.00 | >45.00 |
气体体积/L | 2.80 | 11.2 | 11.2 |
请回答:
(1)盐酸的物质的量浓度是_____。
(2)若固体粉末的质量为x g,该盐酸的体积为140mL,产生的CO2体积为yL(标准状况下)。试写出粉末质量x(g)与产生CO2体积y(L)之间的关系是______。
【答案】5.00mol.L-1 若x≤63g,y=11.2x/45 L ;若x>63g,y=15.68L
【解析】
(1)根据表中信息可知,固体质量为45.00g时,盐酸恰好完全反应,H++HCO3-=CO2![]() +H2O,根据氢离子与二氧化碳的物质的量相等计算;
+H2O,根据氢离子与二氧化碳的物质的量相等计算;
(2)若固体粉末的质量为x g,固体过量时,则盐酸完全反应,生成的气体为5.0mol/L![]() 0.14L=0.7mol,即标况下的15.68L;若盐酸过量,则气体体积为11.2x/45 L;
0.14L=0.7mol,即标况下的15.68L;若盐酸过量,则气体体积为11.2x/45 L;
(1)根据表中信息可知,固体质量为45.00g时,盐酸恰好完全反应,H++HCO3-=CO2![]() +H2O,生成标况下的11.2L即0.5mol,则氢离子的物质的量为0.5mol,溶液为100mL,则浓度为5.0mol/L;
+H2O,生成标况下的11.2L即0.5mol,则氢离子的物质的量为0.5mol,溶液为100mL,则浓度为5.0mol/L;
(2)若固体粉末的质量为x g,固体过量时,则盐酸完全反应,生成的气体为5.0mol/L![]() 0.14L=0.7mol,即标况下的15.68L;若盐酸过量,则气体体积为11.2x/45 L,答案为:若x≤63g,y=11.2x/45 L ;若x>63g,y=15.68L;
0.14L=0.7mol,即标况下的15.68L;若盐酸过量,则气体体积为11.2x/45 L,答案为:若x≤63g,y=11.2x/45 L ;若x>63g,y=15.68L;

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】已知:pKa=-lgKa。25℃时,几种弱酸的pKa值如下表所示。下列说法正确的是
弱酸的化学式 | CH3COOH | HCOOH | H2SO3 |
pKa | 4.74 | 3.74 | 1.90 7.20 |
A. 向Na2SO3溶液中加入过量乙酸,反应生成SO2
B. 25℃时,pH=8的甲酸钠溶液中,c( HCOOH)=9.9×10-7mol·L-1
C. 25℃时,某乙酸溶液pH=a,则等浓度的甲酸pH=a-1
D. 相同温度下,等浓度的 HCOONa溶液比Na2SO3溶液的pH大