题目内容
【题目】钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取CoC12·6H2O粗品的工艺流程图如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、A13+等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
请回答下列问题:
(1)上述工艺流程图中操作a的名称:_______________。
(2)写出“浸出”时Co2O3发生反应的离子方程式:____________________。
(3)加入NaC1O3的作用是________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。使用萃取剂最适宜的pH范围是_________(填字母序号)。
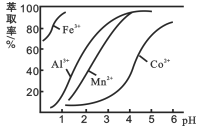
A.2.0~2.5 B. 3.0~3.5 C. 5.0~5.5 D. 9.5~9.8
(5)“除钙”“镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11, Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_______________。
【答案】 过滤 Co2O3+SO32-+4H+=2Co2++SO42-+2H2O 将Fe2+氧化成Fe3+,使Fe3+沉淀完全(利于生成Fe(OH)3除去) B 0.49
【解析】含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则加入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+.工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴;
⑴由分析可知上述工艺流程图中操作a的名称过滤;
(2)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原为Co2+、Fe2+,其中“浸出”时Co2O3发生反应离子方程式为:SO32-+2Fe3++H2O=SO42-+2Fe2++2H+;
(3)NaClO3的作用是:将浸出液中Fe2+氧化为Fe3+,使Fe3+沉淀完全;
(4)pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn2+的萃取率增大很多,而pH=4时,Co2+的萃取率比较大,故pH=3时最佳,故答案为B;
(5)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=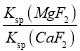 =
=![]() =0.49。
=0.49。

