题目内容
【题目】氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛。
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为___________;(选填:“同一物质”或“同系物”或“同分异构体”)氰酸铵属于_______化合物(选填:“离子”或“共价”)。
(2)液氨是一种贮氢材料,已知:断开1mol共价键吸收的能量数据如表
共价键 | H—H | N—H | N≡N |
kJ·mol-1 | 436 | 390.8 | 946 |
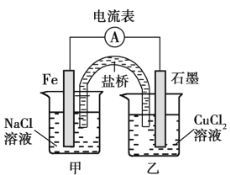
则合成氨反应:N2(g) + 3H2 (g)= 2NH3(g) ,生成2mol氨气放出 _________kJ热量,若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,则此时NH3所占的体积分数为______ 。如图装置通直流电,液氨可电解释放氢气,该过程中能量转化方式为由电能转化为_____能。

(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是_______(不定项选择)。
a.反应速率4v ( NH3) =5v ( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v (正)与v (逆)相等的点为_________(选填字母)。

【答案】同分异构体 离子 90.8 25% 化学 bc cd
【解析】
(1)根据同分异构体的概念判断;
(2)反应N2(g) + 3H2 (g)= 2NH3(g)的反应热![]() =反应物总键能-生成物总键能;若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,列“三段式”计算;图1装置为电解装置,电解是电能转化为化学能;
=反应物总键能-生成物总键能;若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,列“三段式”计算;图1装置为电解装置,电解是电能转化为化学能;
(3)①根据反应平衡时v(正)与v(逆)相等判断;
②达到平衡时v(正)与v(逆)相等。
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)的分子式相同,但结构不同,所以互为同分异构体;氰酸铵属于盐,是离子化合物。故答案为:同分异构体;离子;
(2)反应N2(g) + 3H2 (g)= 2NH3(g)的反应热![]() =反应物总键能-生成物总键能=(946+436
=反应物总键能-生成物总键能=(946+436![]() 3-390.8
3-390.8![]() 6)kJ
6)kJ![]() mol-1=-90.8 kJ
mol-1=-90.8 kJ![]() mol-1,则生成2mol氨气放出90.8kJ热量;若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,则生成氨气
mol-1,则生成2mol氨气放出90.8kJ热量;若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,则生成氨气![]() =0.8mol,有:
=0.8mol,有:
N2(g) + 3H2 (g)= 2NH3(g)
起始1mol 3mol 0mol
转化 0.4mol 1.2mol 0.8mol
平衡0.6mol 1.8mol 0.8mol
此时NH3所占的体积分数为![]()
![]() 100%=25%;图1装置为电解装置,电解是电能转化为化学能;故答案为:90.8;25%;化学;
100%=25%;图1装置为电解装置,电解是电能转化为化学能;故答案为:90.8;25%;化学;
(3) ①a.该反应达到平衡状态时,5v(NH3)正=4v(N2)逆,该选项没有标明正逆反应且比例错误,故a错误;
b.该反应是一个反应前后气体体积增大的可逆反应,当反应达到平衡状态时,容器内压强不随时间的变化而变化,所以能判断反应达到平衡状态,故b正确;
c.容器内N2的物质的量分数不再随时间而发生变化说明浓度不在改变,故c正确;
d.各物质的物质的量之比为6:4:5:6,不能说明正逆反应速率相等或者浓度不变,故d错误;
故选bc;
②达到平衡时v(正)与v(逆)相等,cd点物质的量不再改变,故答案为:cd。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某校化学课外研究小组为验证浓硫酸与金属Zn反应产生的气体中含SO2和H2,进行了下列实验活动:
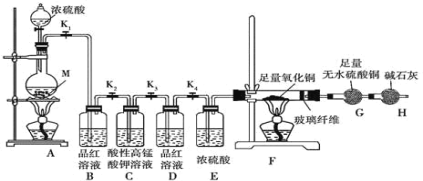
(1)在装入药品前,甲同学需检查装置_____。
(2)填写下表中的实验现象:_____。
装置 | B | F | G |
实验现象 |
(3)装置C的作用是_____,写出装置C中发生反应的离子方程式_____。
(4)装置D的作用是_____。
(5)SO2是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的SO2的含量。
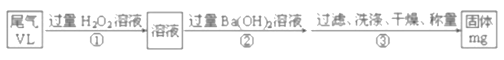
通过的尾气体积为VL(已换算成标准状况)时,该尾气中SO2含量(体积分数)为_____(用含有V、m的代数式表示)。
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛。 “铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为______________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入6mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
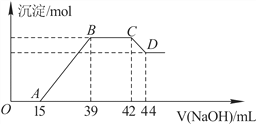
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:____________________
(2)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为__________________。
(3)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________;
(4)熔融物中铝元素的物质的量为________mol。
(5)B点对应的沉淀的物质的量为______mol,A点对应的氢氧化钠溶液的体积为________mL。