题目内容
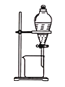
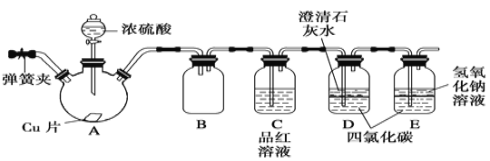
【题目】某学习小组设计如下实验方案研究Cu与浓H2SO4的反应(装置中的固定仪器和酒精灯均未画出):
请回答下列问题:
(1)仪器A的名称_________。Cu与浓H2SO4的反应的化学方程式为________________。
(2)D、E中CCl4的作用是___________________。
(3)加热过程中,随着反应的进行,A容器下有少量白色沉淀生成,你认为该沉淀物是_________,分析可能的原因是________________________________________。
(4)实验结束,打开A容器上的弹簧夹,通入一段时间空气,目的是______________。
(5)以下提供了三种制取CuSO4溶液的方法,你认为最合理的是____________(填序号),并且写出该方法对应的化学方程式_____________________________。
① 用铜与浓硫酸制备硫酸铜溶液。
② 将铜片在空气中加热,再溶解在稀硫酸中即可得到硫酸铜溶液。
③ 在硫酸和铜的混合容器中滴加 H2O2 溶液,过滤得硫酸铜溶液。
【答案】三颈烧瓶或三颈瓶 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 防止倒吸 CuSO4 浓硫酸中含水少,生成的硫酸铜较多,浓硫酸的吸水作用 将装置中的残留的SO2赶到E中,全部被氢氧化溶液吸收,防止空气污染 ③ Cu+H2SO4+H2O2= CuSO4+2H2O
CuSO4+SO2↑+2H2O 防止倒吸 CuSO4 浓硫酸中含水少,生成的硫酸铜较多,浓硫酸的吸水作用 将装置中的残留的SO2赶到E中,全部被氢氧化溶液吸收,防止空气污染 ③ Cu+H2SO4+H2O2= CuSO4+2H2O
【解析】
本实验利用如图所示的装置探究Cu与浓硫酸的反应并验证反应产物,Cu和浓硫酸反应生成二氧化硫气体,C装置用于验证产生的气体是否为二氧化硫,E装置用于吸收二氧化硫气体,防止污染空气,利用D、E所示的装置,装置中将导气管插入到四氯化碳中,二氧化硫不溶于四氯化碳,可以防止倒吸,据此分析。
(1)根据图示,仪器A的名称为三颈烧瓶;浓硫酸和Cu共热反应生成硫酸铜、二氧化硫、水,化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:三颈烧瓶;Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:三颈烧瓶;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)二氧化硫和强碱的反应使容器内压强减小,二氧化硫不溶于四氯化碳,可以采用四氯化碳来达到防止倒吸的目的,故答案为:防止倒吸;
(3)铜和浓硫酸反应生成硫酸铜,加热的情况下,由于A容器中出现大量白色烟雾,导致溶剂减少,且浓硫酸具有吸水性,所以会析出白色固体硫酸铜,故答案为:CuSO4;浓硫酸中含水少,生成的硫酸铜较多,浓硫酸的吸水作用;
(4)实验结束,打开A容器上的弹簧夹,通入一段时间空气,目的是将装置中的残留的SO2赶到E中,全部被氢氧化溶液吸收,防止空气污染,故答案为:将装置中的残留的SO2赶到E中,全部被氢氧化溶液吸收,防止空气污染;
(5)方法①用铜直接和浓硫酸反应,反应过程中生成二氧化硫气体,污染空气;方法②先将铜片在空气中加热生成氧化铜,再将氧化铜溶解在稀硫酸中,加热过程只能将铜片表面的Cu氧化为氧化铜,并不能将内部全部氧化,当表面上的氧化铜被硫酸反应完全后,内部的铜不能和稀硫酸反应;方法③在硫酸和铜的混合溶液中加入双氧水,双氧水这时起到氧化Cu的作用,这样生成物中就没有污染性气体出现,反应产物为硫酸铜和水,综上利用方法③制备硫酸铜最为合理,其反应方程式为Cu+H2SO4+H2O2=CuSO4+2H2O,故答案为:③;Cu+H2SO4+H2O2=CuSO4+2H2O。

【题目】实验室从含碘的废液(除H2O外,含有CCl4、I2、I 等)中回收碘,其实验过程如下,下列各项操作选用的装置不正确的是( )
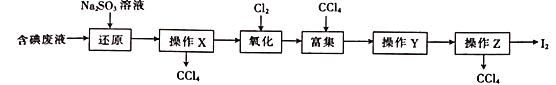
选项 | A | B | C | D |
操作 | 操作X | 氧化 | 操作Y | 操作Z(加热及夹持装置略去) |
装置 |
|
|
|
|
A. AB. BC. CD. D
【题目】已知常温下KClO3与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间,对图中各部位颜色描述正确的是
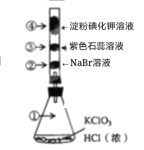
选项 | ① | ② | ③ | ④ |
A | 黄绿色 | 橙色 | 白色 | 蓝色 |
B | 无色 | 橙色 | 白色 | 紫色 |
C | 黄绿色 | 橙色 | 无色 | 蓝色 |
D | 黄绿色 | 无色 | 无色 | 紫色 |
A.AB.BC.CD.D