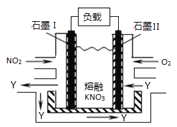
题目内容
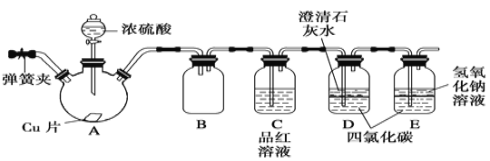
【题目】已知Y、Z是金属单质,F、M是极易溶于水的气体,I元素是地壳中含量仅次于氧的非金属元素,化合物L是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中I元素的质量分数为60%。这些物质间的相互转化关系如框图所示(部分产物已略去),根据框图及提示的信息回答下列问题。
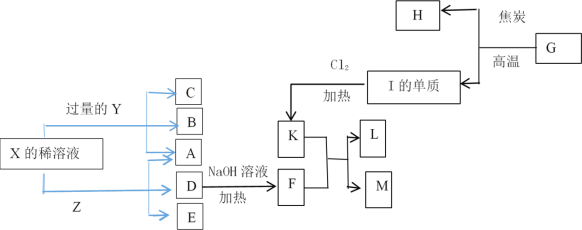
(1)写出I元素在元素周期表中的位置_________________________________。
(2)K和F反应生成L和M的化学方程式_________________________________________。
(3)将5.2 g 金属Z与足量的X的稀溶液充分反应无气体放出,再向溶液中加入过量的NaOH溶液并加热,收集到0.448L气体F(标准状况),则整个过程中转移的电子数为_________。
(4)C是空气质量报告中的一种气体污染物,易形成酸雨;P气体是形成另一类型酸雨的主要污染物。实验室中若想用酸性高锰酸钾溶液除尽P气体,观察到的现象应是____________________,写出相应的离子方程式______________________________ 。
(5)已知向B的溶液中加入NaOH溶液时,先产生白色沉淀,迅速变为灰绿色,最后变为红褐色,请写出过量金属Y与X的稀溶液充分反应的离子方程式 ______________,该反应中被还原的X与未被还原的X的物质的量之比为___________________
【答案】第三周期第IVA族 3SiCl4+4NH3=Si3N4+12HCl 0.16NA或9.632×1022 高锰酸钾溶液紫色变浅 5 SO2+2 MnO![]() +2H2O=5 SO
+2H2O=5 SO![]() +2 Mn2++4H+ 3Fe+8H++2NO
+2 Mn2++4H+ 3Fe+8H++2NO![]() =3Fe2++2NO↑+4H2O 1:3
=3Fe2++2NO↑+4H2O 1:3
【解析】
I元素是地壳中仅次于O的非金属元素,则I为Si元素;物质G与焦炭反应生成Si,说明物质G含有Si元素,物质G为SiO2,物质H为CO;Si与Cl2在加热条件下生成物质K为SiCl4,SiCl4与物质F反应生成物质L和M,F为极易溶于水的气体,可以有物质D与NaOH溶液在加热条件下反应,说明物质F为NH3;化合物L是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中I元素的质量分数为60%,其另一种元素为N元素,则物质L为Si3N4,物质M为HCl;物质D含有铵根,X的稀溶液与金属反应生成三种物质,说明X为硝酸,D为NH4NO3,物质Z与物质Y均可以与稀硝酸反应生成物质A,则物质A为水,物质E为Z的硝酸盐,据此分析。
(1)根据分析,I为Si元素,其在元素周期表中的位置为第三周期第ⅣA族;
(2)根据分析,物质K与物质F反应生成物质L和物质M的化学方程式为3SiCl4+4NH3=Si3N4+12HCl;
(3)将5.2g金属Z与足量的X的稀溶液充分反应无气体放出,再向溶液中加入过量的NaOH溶液并加热,收集到0.448L气体F(标准状况),物质F为![]() =0.02mol,0.02mol氨气全部由硝酸根得电子发生还原反应而来,一个硝酸根得8个电子生成一个铵根,故反应过程中转移电子8×0.02=0.16mol,为0.16NA个;
=0.02mol,0.02mol氨气全部由硝酸根得电子发生还原反应而来,一个硝酸根得8个电子生成一个铵根,故反应过程中转移电子8×0.02=0.16mol,为0.16NA个;
(4)C为空气质量报告中的一种气体污染物,易形成酸雨,则C为NO,则另一种气体P为SO2,利用酸性高锰酸钾除去SO2,反应方程式为5SO2+2![]() +2H2O=5
+2H2O=5![]() +2Mn2++4H+;反应现象为:高锰酸钾溶液紫色变浅;
+2Mn2++4H+;反应现象为:高锰酸钾溶液紫色变浅;
(6)向B的溶液中加入NaOH溶液时,先产生白色沉淀,迅速变为灰绿色,最后变为红褐色,说明B中含有Fe2+,结合物质X,物质B为Fe(NO3)2,则过量金属Y与X的稀溶液充分反应的离子方程式为3Fe+8H++2![]() =3Fe2++2NO↑+4H2O,反应过程中共有8mol
=3Fe2++2NO↑+4H2O,反应过程中共有8mol![]() 参加反应,反应生成2mol NO,有6mol硝酸根没有被还原,故被还原的X与为被还原的X的物质的量的比为2:6=1:3。
参加反应,反应生成2mol NO,有6mol硝酸根没有被还原,故被还原的X与为被还原的X的物质的量的比为2:6=1:3。

 阅读快车系列答案
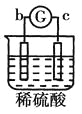
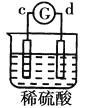
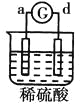
阅读快车系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小b极质量增加 | 溶液中的 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】下列实验操作、现象和所得结论错误的是 ( )
选项 | 操作 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
B | 向久置的Na2SO3溶液中加入足量Ba(NO3)2溶液,再加入足量稀盐酸 | 先出现白色沉淀,然后部分沉淀溶解 | 部分Na2SO3被氧化 |
C | 某溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有Fe2+,可能有Fe3+ |
D | 向等浓度的KCl、KI混合液中逐滴滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
A. AB. BC. CD. D
【题目】I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) ΔH1=+85.2kJ/mol
HCHO(g)+H2(g) ΔH1=+85.2kJ/mol
反应II:CH3OH(g)+![]() O2(g)
O2(g)![]() HCHO(g)+H2O(g) ΔH2
HCHO(g)+H2O(g) ΔH2
反应III:2H2(g)+O2(g)![]() 2H2O(g) ΔH3=—483.6kJ/mol
2H2O(g) ΔH3=—483.6kJ/mol
(1)计算反应Ⅱ的反应热ΔH2=__________________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)![]() MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即υ正=k正·c(Mb)·P(O2),υ逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即υ正=k正·c(Mb)·P(O2),υ逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=_______。
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=_______(用含有k正、k逆的式子表示)。
II.CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g) + 4H2O(g) ΔH=QkJ/mol。一定条件下, 按不同的投料比X[X=
CH2=CH2(g) + 4H2O(g) ΔH=QkJ/mol。一定条件下, 按不同的投料比X[X=![]() ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
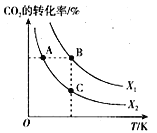
①X1______X2(填“>”或“<”,后同),Q______0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3和NaHCO3。
①已知25℃时0.1mol / L的NaHCO3溶液的pH=8.3,试通过计算确定溶液中各离子浓度由大到小的顺序为_____[已知:常温下H2CO3的电离常数Ka1= 4.4×107、Ka2 = 5×1011 ]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为____。
[已知:常温下Ksp(BaSO4)=1×107、Ksp(BaCO3)=2.5×106 ]。(忽略溶液体积的变化)