题目内容
把含有FeBr2、FeI2各a mol的稀溶液两份,分别通入一定量的Cl2,第一份溶液中有一半的I― 被氧化成I2,第二份溶液中有一半的Br― 被氧化成Br2,两份通入Cl2的物质的量之比
| A.1:1 | B.1:2 | C.1:3 | D.1:5 |
D
解析试题分析:由于还原性:I->Fe2+>Br-,所以第一份溶液中有一半的I―被氧化成I2,则根据反应方程式: Cl2+2I-===2Cl-+I2 可知:反应的I―的物质的量是amol,则消耗的氯气的物质的量为a/2mol;第二份溶液中有一半的Br― 被氧化成Br2,则发生了反应:Cl2+2I-===2Cl-+I2 消耗氯气amol;2Fe2++Cl2="=" 2Cl-+2Fe3+,n(Fe2+)=2amol,消耗氯气amol;Cl2+2Br-===2Cl-+Br2,反应的n(Br-)=" amol;" 消耗氯气a/2mol;因此一共消耗氯气的物质的量是5a/2mol。因此两份通入Cl2的物质的量之比a/2mol:5a/2mol=1:5。故选项是D。
考点:考查微粒的还原性的强弱及反应的先后顺序、和有关计算的知识。

 智慧小复习系列答案
智慧小复习系列答案已知反应KClO3+6HCl = KCl+3Cl2↑+3 H2O,下列判断正确的是
| A.KClO3被氧化 |
| B.氧化剂与还原剂之比为1:6 |
| C.氧化产物是Cl2 |
| D.HCl在化学反应中只能作还原剂 |
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
| A.无水硫酸铜、蔗糖 | B.硅胶、硫酸亚铁 |
| C.食盐、硫酸亚铁 | D.生石灰、食盐 |
根据下列反应事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;
③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、
Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
| A.X>Z>Y>W | B.Z>W>X>Y | C.Z>Y>X>W | D.Z>X>Y>W |
宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2="==2" Ag2S +2H2O,其中H2S是
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
下列反应既属于氧化还原反应,又是吸热反应的是
| A.铝与稀盐酸的反应 | B.甲烷在氧气中的燃烧反应 |
| C.灼热的木炭与CO2反应 | D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 |
Na2O2、CaC2都能与水反应,且反应中都有气体放出。下列说法正确的是
| A.都属于氧化还原反应 | B.生成的气体均为氧化产物 |
| C.反应物水均作氧化剂 | D.反应均放热 |
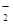 、MnO
、MnO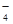 、CO
、CO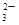 、SO
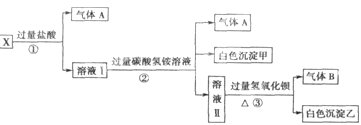
、SO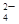 中的若干种离子组成,取溶液进行右图实验:
中的若干种离子组成,取溶液进行右图实验: