题目内容
食盐是日常生活的必需品,也是重要的化工原料。
粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42―等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳。实验室提纯NaCl的流程如下:
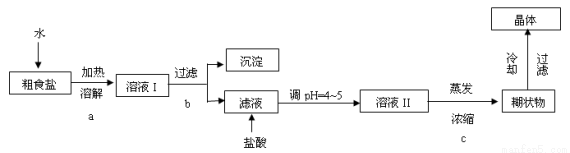
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42―离子,选出A所代表的多种试剂,按滴加顺序依次为i NaOH ii iii (填化学式)。
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i: ;
加入试剂iii: 。
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂 为 。(从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如下:
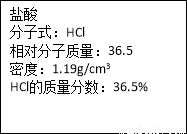
欲用上述浓盐酸配制实验所需浓度的稀盐酸480mL,
①配制需要的玻璃仪器有 (填仪器名称)
②需量取的浓盐酸的体积为: 。
(1)BaCl2溶液、饱和Na2CO3溶液
(2)i: Fe3++3OH―=Fe(OH)3↓, Mg2++2OH―=Mg(OH)2↓
ii:Ba2++CO32―=BaCO3↓ Ca2++CO32―=CaCO3↓
(3)75%乙醇
(4)①20mL量筒、胶头滴管、玻璃棒、烧杯、500mL容量瓶 ②16.8mL
【解析】
试题分析:本题考查的是粗盐的提纯,所选用的试剂中,一定要切记碳酸钠要在氯化钡之后添加,目的是除去过量的氯化钡因此(1)按滴加顺序依次为i NaOH 、ii BaCl2溶液iii饱和Na2CO3溶液。(2)下列试剂加入时发生反应的离子反应方程式:加入试剂i:Fe3++3OH―=Fe(OH)3↓, Mg2++2OH―=Mg(OH)2↓加入试剂iii:ii:Ba2++CO32―=BaCO3↓ Ca2++CO32―=CaCO3↓(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为75%乙醇,因为乙醇有挥发性,残留在晶体表面的少量的乙醇,也会挥发掉。(4)此题是要配制480mL的稀盐酸,但是实验室没有480mL的容量瓶,只能选用500mL的容量瓶来代替,也就是说我们必须配制500mL的溶液。先计算浓盐酸的物质的量的浓度: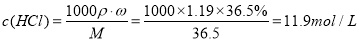
利用稀释定律可知:需量取盐酸的体积为:
此处只能填16.8mL,因为是用量筒来量取液体体积的。
考点:考查粗盐的提纯。

铋(Bi)最高化合价为+5价,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色.现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:
加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.NaBiO3、KMnO4、H2O2、I2 B.KMnO4、NaBiO3、H2O2、I2
C.I2、H2O2、KMnO4、NaBiO3 D.KMnO4、NaBiO3、I2、H2O2
