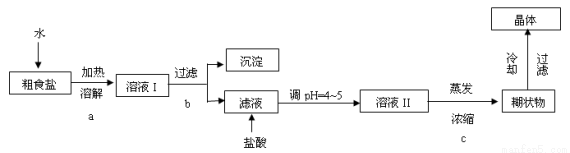
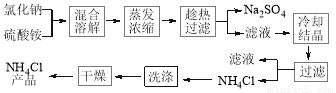
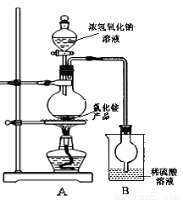
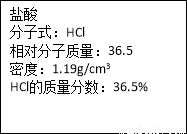题目内容
Fe和Fe2O3 的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3 均无剩余。为中和过量的H2SO4,并使FeSO4 全部转化为Fe(OH)2 沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4 的物质的量浓度为
A.2.25mol/L B.2mol/L C.0.3mol/L D.0.6mol/L
B
【解析】
试题分析:分析题意:该过程中遵循元素守恒规律,溶液中的硫酸根离子的物质的量不变,最后的溶液是硫酸钠溶液,钠元素来自氢氧化钠,所以n(Na+)=2n(SO42-)=0.2L×3mol/L=0.6mol,所以n(SO42-)=0.3mol,c(H2SO4)=0.3mol/0.15L=2mol/L,答案选B。
考点:考查化学反应的计算,守恒规律的应用

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目