题目内容
12.设NA表示阿伏加德罗常数.下列说法不正确的是( )| A. | 质量均为mg的H2SO4和H3PO4中含有的电子数均为50mNA/98 | |
| B. | 标准状况下,1升辛烷完全燃烧后,所生成气态产物的分子数为8NA/22.4个 | |
| C. | 在1L0.5mol•L-1的Na2CO3溶液中,离子总数一定大于1.5NA个 | |
| D. | 1mol H2O2与MnO2充分作用下转移的电子总数为NA个 |
分析 A、硫酸和磷酸的摩尔质量均为98g/mol;
B、标况下辛烷为液态;
C、CO32-的水解导致离子数目增多;
D、双氧水的分解为歧化反应.
解答 解:A、硫酸和磷酸的摩尔质量均为98g/mol,故mg硫酸和磷酸的混合物的物质的量为n=$\frac{m}{98}$mol,而1mol硫酸和1mol磷酸均含50mol电子,故$\frac{m}{98}$mol混合物中含$\frac{50{N}_{A}}{98}$个电子,故A正确;
B、标况下辛烷为液态,故1L辛烷的物质的量不能根据气体摩尔体积来计算,故B错误;
C、CO32-的水解导致离子数目增多,故在1L0.5mol•L-1的Na2CO3溶液中,离子总数一定大于1.5NA个,故C正确;
D、双氧水的分解为歧化反应,1mol双氧水分解转移1mol电子即NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
2.下列说法正确的是( )
| A. | 不同原子构成的物质可能是单质、化合物或混合物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 电解质溶液导电、煤的气化、石油的裂解、烧碱的潮解都是化学变化 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,而物理变化中一定没有化学键的破坏或形成 |
20.如图装置能构成原电池的是( )
| A. | 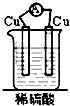 | B. | 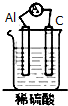 | C. | 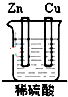 | D. | 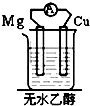 |
7.不是构成原电池必需具备的条件是( )
| A. | 活泼性不同的两极 | B. | 闭合回路 | ||
| C. | 电源 | D. | 电解质溶液 |
17.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法不正确的是( )
| A. | 18O存在于乙酸乙酯中 | |
| B. | 因为反应是可逆的所以18O有可能出现在乙酸中 | |
| C. | 反应中浓硫酸即是催化剂又是脱水剂 | |
| D. | 若与丙酸反应生成的酯的相对分子质量为102 |
20.请参考题中图表,已知E1=134kJ•mol-1、E2=368kJ•mol-1,根据要求回答问题:

(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2 (g)+CO (g)═CO2 (g)+NO (g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应热化学方程式如下:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)═H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH (g)+$\frac{3}{2}$O2 (g)═CO2 (g)+2 H2O (l)△H=-764.7 kJ•mol-1.
(3)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为d kJ•mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=$\frac{1}{4}$(d+6a+5c-12b) kJ•mol-1(用含a、b、c、d的代表数式表示).

(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2 (g)+CO (g)═CO2 (g)+NO (g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应热化学方程式如下:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)═H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH (g)+$\frac{3}{2}$O2 (g)═CO2 (g)+2 H2O (l)△H=-764.7 kJ•mol-1.
(3)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |


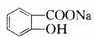 B
B D
D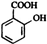 .写出D→E的反应的化学方程式
.写出D→E的反应的化学方程式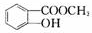 +H2O.
+H2O.