题目内容
9.对铁的氯化物进行下图所示的实验.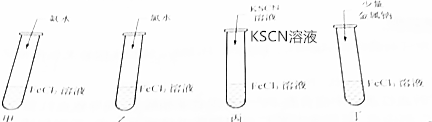
(1)甲中现象红褐色沉淀产生;离子方程式及化学方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+、FeCl3+3NH3•H2O=Fe(OH)3↓+3NH4Cl;
(2)乙中现象白色沉淀生成,迅速变为灰绿色最后为红褐色;离子方程式Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)丙中现象溶液为血红色;离子方程式Fe3++3SCN-=Fe(SCN)3;
(4)丁中现象有气体生成,产生红褐色沉淀;离子方程式2Na+2H2O=2Na++2OH-+H2↑、Fe3++3OH-═Fe(OH)3↓.
分析 (1)铁离子与氨水反应生成红褐色沉淀;
(2)亚铁离子与氨水反应生成氢氧化亚铁白色沉淀,然后白色沉淀被氧化为红褐色沉淀;
(3)铁离子遇KSCN溶液为血红色;
(4)钠与水反应,然后生成的NaOH与氯化铁反应.
解答 解:(1)铁离子与氨水发生反应为FeCl3+3NH3•H2O=Fe(OH)3↓+3NH4Cl,其离子反应为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,观察到红褐色沉淀产生,
故答案为:红褐色沉淀产生;Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+、FeCl3+3NH3•H2O=Fe(OH)3↓+3NH4Cl;
(2)亚铁离子与氨水反应的离子反应为Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+,生成氢氧化亚铁白色沉淀,然后白色沉淀被氧化为红褐色沉淀,发生4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:白色沉淀生成,迅速变为灰绿色最后为红褐色;Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)铁离子遇KSCN溶液,发生FeCl3+3KSCN=3KCl+Fe(SCN)3,离子反应为Fe3++3SCN-=Fe(SCN)3,观察到溶液为血红色,故答案为:溶液为血红色;Fe3++3SCN-=Fe(SCN)3;
(4)钠与水反应,然后生成的NaOH与氯化铁反应,发生2Na+2H2O=2Na++2OH-+H2↑、Fe3++3OH-═Fe(OH)3↓,观察到有气体生成,产生红褐色沉淀,
故答案为:有气体生成,产生红褐色沉淀;2Na+2H2O=2Na++2OH-+H2↑、Fe3++3OH-═Fe(OH)3↓.
点评 本题考查铁及其化合物的性质及离子反应方程式的书写,为高频考点,把握铁的化合物的化学性质为解答的关键,注意发生的反应及现象,侧重分析与应用能力的考查,题目难度不大.

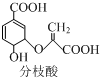
| A. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 | |
| B. | 分子中含有2种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 1mol分枝酸最多可与3molNaOH发生中和反应 |
| A. |  | B. |  | C. | 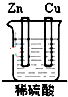 | D. | 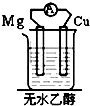 |
| A. | 18O存在于乙酸乙酯中 | |
| B. | 因为反应是可逆的所以18O有可能出现在乙酸中 | |
| C. | 反应中浓硫酸即是催化剂又是脱水剂 | |
| D. | 若与丙酸反应生成的酯的相对分子质量为102 |
| A. | 在稀溶液中,所有酸和碱发生中和反应放出的热量都叫中和热 | |
| B. | 在稀溶液中1mol酸和1mol碱反应放出的热量不一定相等 | |
| C. | 含1molBa(OH)2的稀溶液和1mol稀硫酸完全反应放出的热,即为中和热 | |
| D. | 将浓硫酸滴入氢氧化钠溶液中刚好生成1mol水时,放出的热量为57.3 kJ |
| A. | 合金:都具有金属特性和固定的熔点 | |
| B. | 金属延展性:金属受外力发生形变,但金属键没有被破坏 | |
| C. | 金属导热性:金属内自由电子传递热量 | |
| D. | 用钢材作建材而不是纯铁:钢材的硬度一般比纯铁的硬度大 |
| A. | 反应开始后,反应要放出能量 | |
| B. | 建立平衡状态时c(N2)<3 mol/L | |
| C. | 该条件下,平衡时N2的体积分数为$\frac{1}{14}$ | |
| D. | 反应条件变化时,其K值也一定发生变化 |

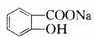 B
B D
D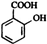 .写出D→E的反应的化学方程式
.写出D→E的反应的化学方程式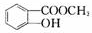 +H2O.
+H2O.