题目内容
(2010?江西模拟)常温下,pH=11的NaOH溶液aL分别与下列3种溶液混合,充分反应后使溶液呈中性:①pH=3的醋酸bL;②物质的量浓度为1×10-3mol/L的醋酸cL;③c(OH-)=1×10-11 mol/L的H2SO4的溶液d L.判断a、b、c、d的大小关系,正确的是( )
分析:常温下,pH=11的NaOH溶液中,氢氧化钠的物质的量浓度为10-3 mol/L,①因为醋酸是弱电解质,pH=3的醋酸物质的量浓度大于10-3 mol/L,②物质的量浓度为1×10-3 mol/L的醋酸,③c(OH-)=1×10-11 mol/L的H2SO4的溶液中氢离子的物质的量浓度为10-3 mol/L.
中和相同物质的量的强碱时,酸的浓度越大,所用酸的体积越小;相同物质的量浓度的强酸和弱酸,中和相同物质的量的强碱,弱酸所用的体积稍多.
中和相同物质的量的强碱时,酸的浓度越大,所用酸的体积越小;相同物质的量浓度的强酸和弱酸,中和相同物质的量的强碱,弱酸所用的体积稍多.
解答:解:①醋酸是弱电解质,所以醋酸的物质的量浓度大于10-3 mol/L③中氢离子的物质的量浓度为10-3 mol/L,所以氢离子的物质的量浓度大小为:①>②=③.
中和相同物质的量的强碱时,氢离子的浓度越大,所用酸的体积越小;相同物质的量浓度的强酸和弱酸,中和相同物质的量的强碱,弱酸所用的体积稍多;所以b最小;氢离子和氢氧根离子以1:1反应生成水,所以a=d;②中酸、③中氢离子的物质的量浓度相等,但醋酸是弱电解质,和强碱完全反应时生成的醋酸钠是强碱弱酸盐其溶液呈碱性,若使溶液呈中性,酸应稍微过量,所以c>d.
所以a、b、c、d的大小关系为c>a=d>b,故选D.
中和相同物质的量的强碱时,氢离子的浓度越大,所用酸的体积越小;相同物质的量浓度的强酸和弱酸,中和相同物质的量的强碱,弱酸所用的体积稍多;所以b最小;氢离子和氢氧根离子以1:1反应生成水,所以a=d;②中酸、③中氢离子的物质的量浓度相等,但醋酸是弱电解质,和强碱完全反应时生成的醋酸钠是强碱弱酸盐其溶液呈碱性,若使溶液呈中性,酸应稍微过量,所以c>d.
所以a、b、c、d的大小关系为c>a=d>b,故选D.
点评:本题考查了酸和强碱的反应,难度不大,注意中和相同物质的量的强碱时,酸的浓度越大,所用酸的体积越小;相同物质的量浓度的强酸和弱酸,中和相同物质的量的强碱,弱酸所用的体积稍多.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
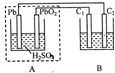 (2010?江西模拟)该图装置中,A为铅蓄电池,C1、C2为石墨电极,B烧杯中是浓度均为0.1mol/L的H2SO3和KI的混合溶液100mL.下列说法正确的是( )
(2010?江西模拟)该图装置中,A为铅蓄电池,C1、C2为石墨电极,B烧杯中是浓度均为0.1mol/L的H2SO3和KI的混合溶液100mL.下列说法正确的是( )