题目内容
【题目】现有短周期A、B、C、D四种元素,它们的原子序数依次增大,A元素形成的-2价阴离子比氦原子的核外电子数多8个;B元素与A元素可组成一种淡黄色固体E;C的最高价氧化物既可以与酸反应,也可以和碱反应;D元素原子的M层上有7个电子。
(1)C元素的名称 ________;D的气态氢化物与H2S相比,稳定性较强的是_______(用化学式表示);
(2)A、B、C、D三种元素形成的简单离子半径由大到小的顺序为___________________(用化学式表示);
(3)A的常见氢化物中有两种,其中含有18个电子的分子的电子式为是______________。
(4)用电子式表示化合物B2A的形成过程__________________________。
(5)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出K2A2与CO2发生反应的化学方程式_______________________________。
【答案】 铝 HCl Cl-> O2->Na+>Al3+ 略 Na2O形成过程(略) 2K2O2+2CO2==2K2CO3+O2
【解析】现有短周期A、B、C、D四种元素,它们的原子序数依次增大,A元素形成的-2价阴离子比氦原子的核外电子数多8个,A是O;B元素与A元素可组成一种淡黄色固体E,B是Na,E是过氧化钠;C的最高价氧化物既可以与酸反应,也可以和碱反应,C是Al;D元素原子的M层上有7个电子,核外电子数是17,D是Cl。则
(1)C元素的名称是铝;氯元素非金属性强于硫,则Cl的气态氢化物与H2S相比,稳定性较强的是HCl;(2)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则A、B、C、D三种元素形成的简单离子半径由大到小的顺序为Cl-> O2->Na+>Al3+;(3)A的常见氢化物中有两种,其中含有18个电子的分子是双氧水,电子式为是![]() 。(4)氧化钠的形成过程为
。(4)氧化钠的形成过程为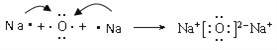 。(5)根据过氧化钠和二氧化碳的反应可判断K2O2与CO2发生反应的化学方程式为2K2O2+2CO2=2K2CO3+O2。
。(5)根据过氧化钠和二氧化碳的反应可判断K2O2与CO2发生反应的化学方程式为2K2O2+2CO2=2K2CO3+O2。

【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
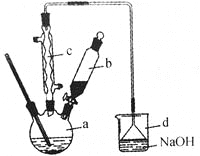
苯 | 溴 | 溴苯 | |
密度/g﹒cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须要做的是 (填入正确操作前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取