题目内容
1.元素R的气态氢化物化学式为H2R,下列叙述不正确的是( )| A. | 该元素的原子最外层上有6个电子 | |
| B. | 该元素最高价氧化物的化学式为RO2 | |
| C. | 该元素是非金属元素 | |
| D. | 该元素最高价含氧酸的化学式为H2RO4 |
分析 某元素R的气态氢化物的化学式为H2R,则R元素最低负化合价为-2,R为非金属元素,其最高正化合价为+6,结合化合价判断最外层电子数及相应化学式.
解答 解:元素R的气态氢化物的化学式为H2R,则R元素最低负化合价为-2,则其最高正化合价为+6,
A.R元素最高正化合价为+6,故其原子最外层电子数为6,故A正确;
B.该元素的原子高正价为+6,则最高正化合价氧化物的化学式为RO3,故B错误;
C.由于元素R形成气态氢化物H2R,R元素最低负化合价为-2,R为非金属元素,故C正确;
D.该元素的原子高正价为+6,该元素最高价氧化物对应的水化物的化学式为H2RO4,故D正确,
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,侧重于学生的分析能力的考查,难度不大,注意根据元素化合价进行分析解答.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
11.甲烷、乙烯属于不同类型的有机化合物,但它们之间也有共性.下列关于它们之间共同特点的说法正确的有( )
| A. | 都由C和H两种元素组成的饱和烃 | |
| B. | 都能使酸性KMnO4溶液褪色 | |
| C. | 都能发生加成反应和取代反应 | |
| D. | 在氧气中完全燃烧后都生成CO2和H2O |
12.下列实验操作正确且能达到预期目的是( )
| 实验目的 | 操 作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明溶液中含有SO42- | 滴入盐酸酸化的硝酸钡溶液 |
| ③ | 欲证明溶液中含有S2- | 取少量溶液滴在醋酸铅试纸上看是否变黑 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁的金属活动性强弱 | 用Pt作电极电解Mg(NO3)2、Cu( NO3)2 混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的PH |
| A. | ①⑤⑥ | B. | ②③⑤ | C. | ①④⑤ | D. | ①②③④⑤⑥ |
9.下列有关实验的操作或现象描述正确的是( )
| A. | 用浓硫酸可区分蛋白质溶液和淀粉溶液 | |
| B. | 在蛋白质溶液中滴加硫酸铜溶液,生成白色沉淀,加水后,沉淀溶解 | |
| C. | 皂化实验后期加入饱和食盐水使高级脂肪酸盐析出,浮在混合液上面,通过纱布可滤去水层 | |
| D. | 取淀粉水解液,加入新制Cu(OH)2浊液,加热,未见砖红色沉淀生成,说明淀粉尚未水解 |
6.含有碳氢氧三种元素,相对分子质量为60的有机物,当其与钠反应放出氢气时,其结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
13.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) $?_{充电}^{放电}$2PbSO4(s)+2H2O(l)市场上一种手提应急灯,主要是“无液干粉”铅蓄电池,其原理是将浓硫酸灌注到硅胶凝胶中去,改善了电池的性能.下列说法不正确的是( )
| A. | 放电时,电子由Pb通过外电路转移到PbO2 | |
| B. | 充电时阴极反应:PbSO4+2e-=Pb(s)+SO42-(aq) | |
| C. | 充电时,电源的正极接铅蓄电池标“-”的一极 | |
| D. | “无液干粉”铅蓄电池中的电解质溶液不易发生泄漏 |

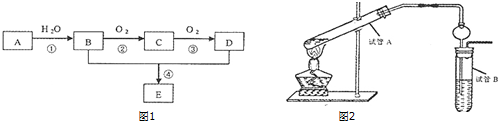
 ,化合物Ⅱ完全燃烧消耗O211.5 mol.
,化合物Ⅱ完全燃烧消耗O211.5 mol.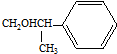 .化合物Ⅳ与新制Cu(OH)2反应的化学方程式
.化合物Ⅳ与新制Cu(OH)2反应的化学方程式 .
.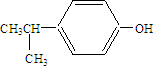 .
.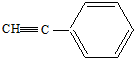 能发生类似反应①的反应经两步生成化合物Ⅶ,Ⅶ的结构简式为
能发生类似反应①的反应经两步生成化合物Ⅶ,Ⅶ的结构简式为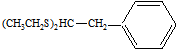 .
.