题目内容
下列工业生产的反应原理不涉及氧化还原反应的是
- A.钢铁厂高炉炼铁
- B.工业上以氨气为原料用氨碱法生产纯碱
- C.硝酸厂以氨气为原料制取硝酸
- D.氯碱厂利用氯化钠生产氯气和烧碱
B
分析:有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化.
解答:A.炼铁厂涉及的反应方程式有C+O2 CO2、CO2+C
CO2、CO2+C 2CO、3CO+Fe2O3
2CO、3CO+Fe2O3 2Fe+3CO2,这几个反应都有电子的转移,所以涉及氧化还原反应,故A不选;
2Fe+3CO2,这几个反应都有电子的转移,所以涉及氧化还原反应,故A不选;
B.氨碱法生产纯碱涉及的方程式为:NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl、2NaHCO3 Na2CO3+CO2↑+H2O,这几个方程式中都没有电子的转移,所以不涉及氧化还原反应,故B选;
Na2CO3+CO2↑+H2O,这几个方程式中都没有电子的转移,所以不涉及氧化还原反应,故B选;
C.涉及的反应有4NH3+5O2 4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,这几个反应都有电子的转移,所以涉及氧化还原反应,故C不选;
4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,这几个反应都有电子的转移,所以涉及氧化还原反应,故C不选;
D.涉及的反应为:2NaCl+2H2O Cl2↑+H2↑+2NaOH,该反应中有电子的转移,属于氧化还原反应,故D不选;
Cl2↑+H2↑+2NaOH,该反应中有电子的转移,属于氧化还原反应,故D不选;
故选B.
点评:本题考查氧化还原反应,明确元素化合价是解本题关键,难度不大.
分析:有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化.
解答:A.炼铁厂涉及的反应方程式有C+O2
 CO2、CO2+C
CO2、CO2+C 2CO、3CO+Fe2O3
2CO、3CO+Fe2O3 2Fe+3CO2,这几个反应都有电子的转移,所以涉及氧化还原反应,故A不选;
2Fe+3CO2,这几个反应都有电子的转移,所以涉及氧化还原反应,故A不选;B.氨碱法生产纯碱涉及的方程式为:NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl、2NaHCO3
 Na2CO3+CO2↑+H2O,这几个方程式中都没有电子的转移,所以不涉及氧化还原反应,故B选;
Na2CO3+CO2↑+H2O,这几个方程式中都没有电子的转移,所以不涉及氧化还原反应,故B选;C.涉及的反应有4NH3+5O2
 4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,这几个反应都有电子的转移,所以涉及氧化还原反应,故C不选;
4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,这几个反应都有电子的转移,所以涉及氧化还原反应,故C不选;D.涉及的反应为:2NaCl+2H2O
 Cl2↑+H2↑+2NaOH,该反应中有电子的转移,属于氧化还原反应,故D不选;
Cl2↑+H2↑+2NaOH,该反应中有电子的转移,属于氧化还原反应,故D不选;故选B.
点评:本题考查氧化还原反应,明确元素化合价是解本题关键,难度不大.

练习册系列答案
相关题目

请回答下列问题:
(2)平衡时反应物的转化率:实验Ⅲ比实验I______(填“大”、“小”或“相同”)。
(3)与实验I比较,实验Ⅱ改变的条件为__________, 判断依据是______________________。
(4)实验Ⅲ的平衡常数K=_________;恒温恒容条件下,向实验Ⅲ达到平衡的容器中通入N2和NH3,使N2 和NH3浓度均变为原平衡的2倍,平衡__________(填编号)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判断是否移动
(2)平衡时反应物的转化率:实验Ⅲ比实验I______(填“大”、“小”或“相同”)。
(3)与实验I比较,实验Ⅱ改变的条件为__________, 判断依据是______________________。
(4)实验Ⅲ的平衡常数K=_________;恒温恒容条件下,向实验Ⅲ达到平衡的容器中通入N2和NH3,使N2 和NH3浓度均变为原平衡的2倍,平衡__________(填编号)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判断是否移动
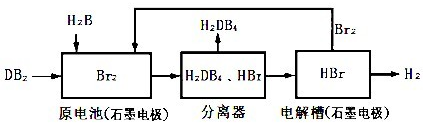
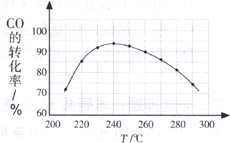 (2010?广州一模)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.
(2010?广州一模)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.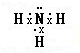
 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。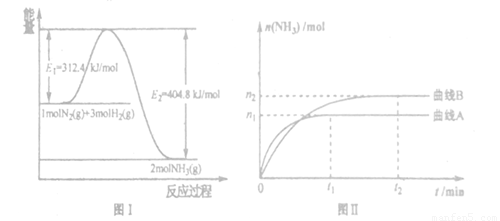
 mol/(L·min)
mol/(L·min) 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______ 2NH3(g)。实验室模拟化工生产,控制起始浓度均为
2NH3(g)。实验室模拟化工生产,控制起始浓度均为