题目内容
氢气在化学工业中有广泛用途。
(1)实验室用锌和稀硫酸制取氢气,反应过程中,溶液中水的电离平衡______移动(填“向左”、“向右”或“不”);若加入少量的_________(填编号),产生氢气速率加快。
A.NaNO3 B.CuSO4 C.CH3COONa D.NaHSO3
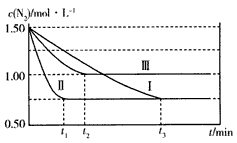
工业合成氨的反应原理为N2(g)+3H2(g) 2NH3(g)。实验室模拟化工生产,控制起始浓度均为
2NH3(g)。实验室模拟化工生产,控制起始浓度均为
c(N2)= 1.50 mol/L、c(H2)=2.50 mol/L,分别在三种不同实验条件下反应,N2浓度随时间变化如下图。
请回答下列问题:
(2)平衡时反应物的转化率:实验Ⅲ比实验I______(填“大”、“小”或“相同”)。
(3)与实验I比较,实验Ⅱ改变的条件为__________, 判断依据是______________________。
(4)实验Ⅲ的平衡常数K=_________;恒温恒容条件下,向实验Ⅲ达到平衡的容器中通入N2和NH3,使N2 和NH3浓度均变为原平衡的2倍,平衡__________(填编号)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判断是否移动
(2)平衡时反应物的转化率:实验Ⅲ比实验I______(填“大”、“小”或“相同”)。
(3)与实验I比较,实验Ⅱ改变的条件为__________, 判断依据是______________________。
(4)实验Ⅲ的平衡常数K=_________;恒温恒容条件下,向实验Ⅲ达到平衡的容器中通入N2和NH3,使N2 和NH3浓度均变为原平衡的2倍,平衡__________(填编号)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判断是否移动
(1)向右;B
(2)小
(3)加入催化剂;实验Ⅱ和实验I的平衡状态相同,而实验Ⅱ达到平衡所需时间短
(4)1.00;B
(2)小
(3)加入催化剂;实验Ⅱ和实验I的平衡状态相同,而实验Ⅱ达到平衡所需时间短
(4)1.00;B

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目