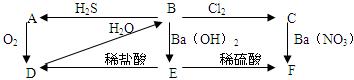
题目内容
(共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的核外电子排布为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: ;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为 。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式 。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L。
(1)Z原子的核外电子排布为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: ;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为 。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式 。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L。
(共12分).(1)1s22s22p4(2分) (2)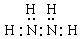 (2分)
(2分)
(3)3Cu + 2NO3— + 8H+ ="==" 3Cu2+ + 2NO↑ + 4H2O (2分)
(4)NH4++HSO3-+2OH- NH3+H2O+SO32- (2分) (5)HN3(2分);2.24L(2分)
NH3+H2O+SO32- (2分) (5)HN3(2分);2.24L(2分)
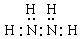 (2分)
(2分)(3)3Cu + 2NO3— + 8H+ ="==" 3Cu2+ + 2NO↑ + 4H2O (2分)
(4)NH4++HSO3-+2OH-
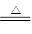 NH3+H2O+SO32- (2分) (5)HN3(2分);2.24L(2分)
NH3+H2O+SO32- (2分) (5)HN3(2分);2.24L(2分)X是原子半径最小的元素,则X是H。如果设Y的质子数是a,则根据元素的结构及位置可知,Z、W的质子数分别是a+1和a+9,因此有1+a+a+1+a+9=32,解得a=7,所以Y是N,Z是O,W是S。
(1)根据构造原理可知,氧原子的核外电子排布为1s22s22p4。
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,所以甲的化学式是N2H4,其电子式是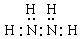
(3)该强酸是硝酸,反应的方程式是3Cu + 2NO3— + 8H+ ="==" 3Cu2+ + 2NO↑ + 4H2O。
(4)1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况),说明含有1个NH4+,所以乙是亚磷酸氢铵,和过量的氢氧化钠反应的方程式是NH4++HSO3-+2OH-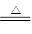 NH3+H2O+SO32-。
NH3+H2O+SO32-。
(5)氮原子的个数是43×0.977÷14=3,所以氢原子数是1个,即分子式是HN3;2.15g该化合物的物质的量是0.05mol。反应的方程式是2HN3=H2+3N2,所以生成氢气和氮气的物质的量分别是0.025mol和0.075mol,共计是0.1mol,标准状况下的体积是2.24L。
(1)根据构造原理可知,氧原子的核外电子排布为1s22s22p4。
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,所以甲的化学式是N2H4,其电子式是
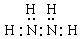
(3)该强酸是硝酸,反应的方程式是3Cu + 2NO3— + 8H+ ="==" 3Cu2+ + 2NO↑ + 4H2O。
(4)1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况),说明含有1个NH4+,所以乙是亚磷酸氢铵,和过量的氢氧化钠反应的方程式是NH4++HSO3-+2OH-
 NH3+H2O+SO32-。
NH3+H2O+SO32-。(5)氮原子的个数是43×0.977÷14=3,所以氢原子数是1个,即分子式是HN3;2.15g该化合物的物质的量是0.05mol。反应的方程式是2HN3=H2+3N2,所以生成氢气和氮气的物质的量分别是0.025mol和0.075mol,共计是0.1mol,标准状况下的体积是2.24L。

练习册系列答案
相关题目
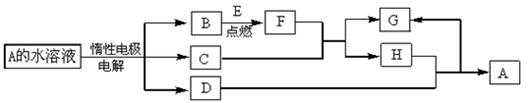
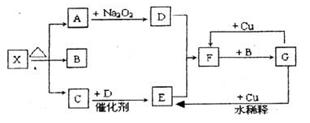
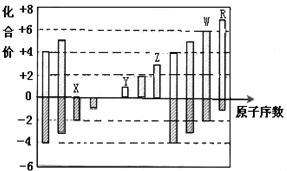
 放出H2S 气体1008mL(已折算成标准状况)
放出H2S 气体1008mL(已折算成标准状况)