题目内容
【题目】中学化学中的一些常见物质有如图转化关系(部分产物未给出).其中A、H的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.
回答下列问题.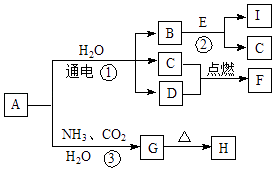
(1)D的电子式为 .
(2)H的化学式为 .
(3)写出反应①的化学方程式 .
(4)写出反应②的离子方程式 .
【答案】
(1)![]()
(2)Na2CO3
(3)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(4)2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
【解析】解:D气体在常温下呈黄绿色,则D为Cl2 , A、G的焰色反应为黄色,含有Na元素,反应③为侯氏制碱法反应原理之一,则A为NaCl,G为NaHCO3 , H为Na2CO3 , 电解氯化钠溶液生成氢气、氯气与氢氧化钠,E是常见金属,与B反应达到C与I,则E为Al、B为NaOH、C为H2 , I为NaAlO2 , F为HCl,(1)D为氯气,电子式为 ![]() ,故答案为:
,故答案为: ![]() ;(2)H的化学式为:Na2CO3 , 故答案为:Na2CO3;(3)反应①的化学方程式:2NaCl+2H2O
;(2)H的化学式为:Na2CO3 , 故答案为:Na2CO3;(3)反应①的化学方程式:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;(4)反应②的离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故答案为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑.
2NaOH+Cl2↑+H2↑;(4)反应②的离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故答案为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑.
D气体在常温下呈黄绿色,则D为Cl2 , A、G的焰色反应为黄色,含有Na元素,反应③为侯氏制碱法反应原理之一,则A为NaCl,G为NaHCO3 , H为Na2CO3 , 电解氯化钠溶液生成氢气、氯气与氢氧化钠,E是常见金属,与B反应达到C与I,则E为Al、B为NaOH、C为H2 , I为NaAlO2 , F为HCl.

 世纪百通期末金卷系列答案
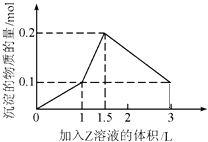
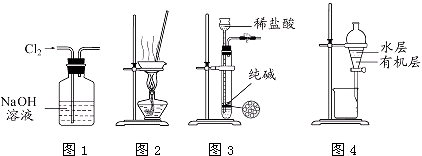
世纪百通期末金卷系列答案【题目】研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂.该实验(填“能”或“不能”)达到目的,原因是 . 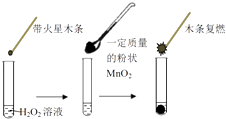
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,
在一定质量范围内,加入不同质量的MnO2 , 测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积/mL | 49 | 61 | 86 |
由此得出的结论是 , 原因是 .
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL 5% H2O2 ):
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1molL﹣1FeCl3 | 5滴0.1molL﹣1 CuCl2 | 5滴0.3molL﹣1 NaCl |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是 , 实验Ⅲ的目的是 .
(4)①查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个
氧化还原反应的化学方程式分别是和(按反应发生的顺序写).
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是 .