题目内容
【题目】在相同温度时,100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量
B.与Mg反应的起始速率
C.OH﹣的物质的量浓度
D.溶液中 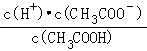
【答案】C
【解析】解:相同温度时,醋酸的电离程度与酸浓度成反比, A.中和时所需NaOH的量与醋酸的物质的量成正比,n(CH3COOH)=0.01mol/L×0.1L=0.1mol/L×0.01L=0.001mol,两种酸的物质的量相等,则消耗的NaOH相等,故A错误;
B.反应速率与氢离子浓度成正比,前者醋酸电离程度大、后者醋酸电离程度小,则溶液中c(H+)前者大于后者,所以开始与镁反应速率:前者大于后者,故B错误;
C.醋酸溶液中c(OH﹣)与溶液中c(H+)成反比,溶液中c(H+)前者大于后者,所以c(OH﹣)前者小于后者,故C正确;
D.溶液中 ![]() =Ka,电离平衡常数只与温度有关,温度不变,离子积常数不变,故D错误;
=Ka,电离平衡常数只与温度有关,温度不变,离子积常数不变,故D错误;
故选C.
相同温度时,醋酸的电离程度与酸浓度成反比,
A.中和时所需NaOH的量与醋酸的物质的量成正比;
B.反应速率与氢离子浓度成正比;
C.醋酸溶液中c(OH﹣)与溶液中c(H+)成反比;
D.溶液中 ![]() =Ka,电离平衡常数只与温度有关.
=Ka,电离平衡常数只与温度有关.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目


