题目内容
7.将50mL某AlCl3溶液加入30mL 1mol/L NaOH溶液或50mL 1.8mol/L NaOH溶液中,均能得到0.78g白色沉淀.则此AlCl3溶液的浓度是( )| A. | 0.5 mol/L | B. | 0.4 mol/L | C. | 0.3 mol/L | D. | 0.2 mol/L |
分析 由信息可知,加到30mL 1mol/LNaOH溶液中只发生Al3++3OH-═Al(OH)3↓,加到50mL 1.8mol/LNaOH溶液中发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,以此来计算解答.
解答 解:0.78gAl(OH)3沉淀,其物质的量为$\frac{0.78g}{78g/mol}$=0.01mol,
①由加到30mL 1mol/LNaOH溶液中只发生Al3++3OH-═Al(OH)3↓,
碱完全反应,则AlCl3溶液的浓度应≥$\frac{0.01mol}{0.05L}$=0.2mol/L,
②由加到50mL 1.8mol/LNaOH溶液中发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
设此AlCl3溶液的溶质的物质的量为x,则
Al3++3OH-═Al(OH)3↓
x 3x x
Al(OH)3+OH-═AlO2-+2H2O
x-0.01 x-0.1
根据消耗的碱的物质的量可知,3x+(x-0.01)=0.05×1.8,
解得x=0.025mol,
此AlCl3溶液的浓度为$\frac{0.025mol}{0.05L}$=0.5mol/L,
由①②可知,此AlCl3溶液的浓度为0.5mol/L,
故选A.
点评 本题考查铝离子与碱的反应,明确碱的物质的量对发生的化学反应的影响、氢氧化铝的能溶于强碱时解答本题的关键,难度不大.

练习册系列答案
相关题目
17. 人类最早使用的合金是由铜、锡形成的青铜,我国的锡储量占世界第一位.明代宋应星所著《天工开物》记载的炼锡方法基本上就是现代用的碳还原法,该反应的化学方程式为:SnO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Sn+2CO↑.该反应类型属于( )
人类最早使用的合金是由铜、锡形成的青铜,我国的锡储量占世界第一位.明代宋应星所著《天工开物》记载的炼锡方法基本上就是现代用的碳还原法,该反应的化学方程式为:SnO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Sn+2CO↑.该反应类型属于( )
 人类最早使用的合金是由铜、锡形成的青铜,我国的锡储量占世界第一位.明代宋应星所著《天工开物》记载的炼锡方法基本上就是现代用的碳还原法,该反应的化学方程式为:SnO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Sn+2CO↑.该反应类型属于( )
人类最早使用的合金是由铜、锡形成的青铜,我国的锡储量占世界第一位.明代宋应星所著《天工开物》记载的炼锡方法基本上就是现代用的碳还原法,该反应的化学方程式为:SnO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Sn+2CO↑.该反应类型属于( )| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
15.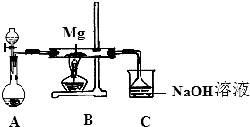 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
(1)选择制取SO2的合适试剂②③(填编号).
①浓HCl ②浓H2SO4 ③Na2SO3 固体 ④CaSO3 固体
(2)上述装置还可优化,优化的方法是在A和B之间未连接一干燥装置,装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境.
(3)甲同学推测Mg 与SO2的反应与CO2相似,则该反应方程式为2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S.
乙同学的推测是:2Mg+3SO2=2MgSO3+S;丙同学的推测是:3Mg+SO2=2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀.
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选.
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是向反应后所得固体加过量2mol/L盐酸,固体未完全溶解且品红溶液不褪色(或反应后固体未完全溶解于盐酸且无气体产生).
(4)上述实验需要100mL,2mol/L 的HCl,配制时选用25mL(选填10mL、25mL、50mL 或100mL)量筒量取36.5%,密度1.19g/mL 的浓盐酸的体积为16.8mL.
 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.(1)选择制取SO2的合适试剂②③(填编号).
①浓HCl ②浓H2SO4 ③Na2SO3 固体 ④CaSO3 固体
(2)上述装置还可优化,优化的方法是在A和B之间未连接一干燥装置,装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境.
(3)甲同学推测Mg 与SO2的反应与CO2相似,则该反应方程式为2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S.
乙同学的推测是:2Mg+3SO2=2MgSO3+S;丙同学的推测是:3Mg+SO2=2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀.
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选.
| 序号 | 实验步骤 | 预期现象和结论 |
| 1 | 取少量反应后所得固体于试管中 | |
| 2 | 向试管中的固体慢慢滴加2mol/L 盐酸至过量,试管口塞上导管的单孔塞,并将导管通入盛有品红的试管中 | 若试管中的固体完全溶解,则丙同学推测正确.若试管中的固体未完全溶解,且品红溶液褪色,则乙同学推测正确. |
(4)上述实验需要100mL,2mol/L 的HCl,配制时选用25mL(选填10mL、25mL、50mL 或100mL)量筒量取36.5%,密度1.19g/mL 的浓盐酸的体积为16.8mL.
2.下列工业生产过程中涉及不到氧化还原反应的是( )
| A. | 接触法制硫酸 | B. | 侯德榜制纯碱 | ||
| C. | 粗铜精炼 | D. | 石油的裂化和裂解 |
17.下列电子式或结构式错误的是( )
| A. | OH-的电子式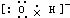 | B. | NH4Br的电子式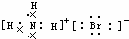 | C. | Na2O的电子式: | D. | Na+的电子式:Na+ |
