题目内容
 化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能.
化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能.(1)装置Ⅰ可用于多种气体的制备,开始实验前检查其气密性是否良好的方法是
(2)甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ中的化学反应方程式为
(3)乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
(4)丙同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置Ⅰ中发生的反应离子方程式为
(5)丁同学认为利用装置Ⅰ可作为实验室制氨气的快速发生器,则b仪器中试剂是
考点:常见气体制备原理及装置选择,气体的净化和干燥
专题:实验题
分析:(1)利用是否能形成液柱差来判断;
(2)甲同学认为装置Ⅰ可作为实验室制取O2的发生器,则为固体与液体反应,可以为双氧水与二氧化锰反应,也可以是过氧化钠与水反应;根据方程式判断转移的电子数;
(3)根据一氧化氮的化学性质,必须使用排水法收集一氧化氮;
(4)根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,判断可能发生的反应;
(5)根据浓氨水的电离平衡原理选择药品.
(2)甲同学认为装置Ⅰ可作为实验室制取O2的发生器,则为固体与液体反应,可以为双氧水与二氧化锰反应,也可以是过氧化钠与水反应;根据方程式判断转移的电子数;
(3)根据一氧化氮的化学性质,必须使用排水法收集一氧化氮;
(4)根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,判断可能发生的反应;
(5)根据浓氨水的电离平衡原理选择药品.
解答:
解:(1)装置Ⅰ处连接导管,将导管末端插入水中,双手捂住烧瓶,导管末端有气泡,松手后导管中形成一端稳定的水柱,说明气密性良好;
故答案为:装置Ⅰ处连接导管,将导管末端插入水中,双手捂住烧瓶,导管末端有气泡,松手后导管中形成一端稳定的水柱,说明气密性良好;
(2)甲同学认为装置Ⅰ可作为实验室制取O2的发生器,则为固体与液体反应,可以为双氧水与二氧化锰反应:
2H2O2
2H2O+O2↑,也可以是过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑;由方程式可知生成1个氧气分子转移2个电子,每制得0.5mol氧气,转移电子的物质的量为1mol;
故答案为:2H2O2
2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑;1;
(3)由于一氧化氮能够与空气中的氧气反应生成二氧化氮,且一氧化氮不溶于水,所以只能采用排水法收集一氧化氮,若利用装置Ⅱ可收集NO,可以将广口瓶中装满水,一氧化氮从d管口进入即可,
故答案为:将广口瓶中装满水,一氧化氮从d管口进入;
(4)根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,证明氧化性:Cl2>Br2,装置Ⅰ是实验室制氯气,反应离子方程式:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,如氯气氧化性大于Br2,则将氯气通入NaBr溶液中溶液变为橙黄色,说明有Br2生成,反应的化学方程式为2Br-+Cl2═2Cl-+Br2;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;NaBr溶液;溶液变为橙黄色;
(5)浓氨水中存在电离平衡:NH3+H2O NH3?H2O
NH3?H2O NH4++OH-,可以加入生石灰(或者氢氧化钠)增大氨水中的氢氧根离子浓度,同时溶解放热,平衡逆向移动产生氨气;
NH4++OH-,可以加入生石灰(或者氢氧化钠)增大氨水中的氢氧根离子浓度,同时溶解放热,平衡逆向移动产生氨气;
故答案为:氢氧化钠或生石灰;溶解放热,OH-浓度增大使氨水中平衡逆向移动.
故答案为:装置Ⅰ处连接导管,将导管末端插入水中,双手捂住烧瓶,导管末端有气泡,松手后导管中形成一端稳定的水柱,说明气密性良好;
(2)甲同学认为装置Ⅰ可作为实验室制取O2的发生器,则为固体与液体反应,可以为双氧水与二氧化锰反应:
2H2O2
| ||
故答案为:2H2O2
| ||
(3)由于一氧化氮能够与空气中的氧气反应生成二氧化氮,且一氧化氮不溶于水,所以只能采用排水法收集一氧化氮,若利用装置Ⅱ可收集NO,可以将广口瓶中装满水,一氧化氮从d管口进入即可,
故答案为:将广口瓶中装满水,一氧化氮从d管口进入;
(4)根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,证明氧化性:Cl2>Br2,装置Ⅰ是实验室制氯气,反应离子方程式:MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(5)浓氨水中存在电离平衡:NH3+H2O
 NH3?H2O
NH3?H2O NH4++OH-,可以加入生石灰(或者氢氧化钠)增大氨水中的氢氧根离子浓度,同时溶解放热,平衡逆向移动产生氨气;
NH4++OH-,可以加入生石灰(或者氢氧化钠)增大氨水中的氢氧根离子浓度,同时溶解放热,平衡逆向移动产生氨气;故答案为:氢氧化钠或生石灰;溶解放热,OH-浓度增大使氨水中平衡逆向移动.
点评:本题考查了气体的实验室制法、非金属性强弱比较、一氧化氮的收集方法,难度不大,可以根据物质的性质和比较规律来解答.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
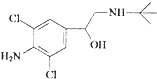 去年央视“315特别行动”又曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某中“瘦肉精”含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,正确的是( )
去年央视“315特别行动”又曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某中“瘦肉精”含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,正确的是( )| A、该物质的分子式为C12H16ON2Cl2 |
| B、该物质不能与盐酸反应 |
| C、该物质的核磁共氢振谱图中有9个吸收峰 |
| D、该物质能发生的类型有:加成反应、酯反应、消去反应、氧化反应等 |
下列关于53131I的说法正确的是( )
| A、质量数为53 |
| B、中子数为78 |
| C、质子数为131 |
| D、电子数为78 |
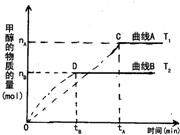 在体积为3L的密闭容器中,CO和H2在一定条件下反应生成甲醇:
在体积为3L的密闭容器中,CO和H2在一定条件下反应生成甲醇:
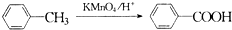
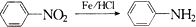 (苯胺,易被氧化)
(苯胺,易被氧化)





 (R为烃基)
(R为烃基) 反应合成聚碳酯的化学方程式
反应合成聚碳酯的化学方程式