题目内容
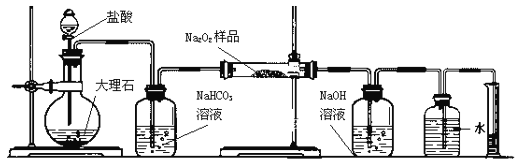
【题目】用0.1000 mol/L NaOH溶液滴定20.00 mL 0.1000 mol/L的H3A溶液的滴定曲线如图所示。己知H3A的pKa1-pKa3分别为2、7和12(pKa=-lgKa)下列说法正确的是

A.滴定前溶液pH值约为3
B.第一个计量点可以用酚酞作为指示剂
C.到达第二个计量点时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达第三个计量点时,微热溶液,![]() 会增大
会增大
【答案】C
【解析】
A.己知pKa1=2,即lgKa1=-2,则Ka1=10-2,由H3A![]() H2A-+H+可知未滴定前Ka1=
H2A-+H+可知未滴定前Ka1=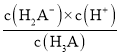 ,则c(H+)≈
,则c(H+)≈![]() mol/L=10-1.5mol/L,此时溶液pH=1.5,故A错误;
mol/L=10-1.5mol/L,此时溶液pH=1.5,故A错误;
B.第一个计量点恰好完全反应生成NaH2A,此时溶液中H2A-的水解常数Kh=![]() =
=![]() =10-10,即H2A-的电离程度大于H2A-的水解程度,溶液显酸性,则不能使用酚酞作指示剂,可选择甲基橙作指示剂,故B错误;
=10-10,即H2A-的电离程度大于H2A-的水解程度,溶液显酸性,则不能使用酚酞作指示剂,可选择甲基橙作指示剂,故B错误;
C.到达第二个计量点时恰好生成Na2HA,此时溶液中HA2-的水解常数Kh2=![]() =
=![]() =10-7,即HA2-的电离程度等于HA2-的水解程度,溶液显中性,由溶液中的电荷守恒式c(Na+)+ c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-)可得c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-),故C正确;
=10-7,即HA2-的电离程度等于HA2-的水解程度,溶液显中性,由溶液中的电荷守恒式c(Na+)+ c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-)可得c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-),故C正确;
D.到达第三个计量点时,恰好生成Na3A,此时溶液中存在A3-的三级水解,且加热促进水解,即加热过程中c(A3-)减小,c(H2A-)增大,则![]() 会减小,故D错误;
会减小,故D错误;
故答案为C。

 名校课堂系列答案
名校课堂系列答案【题目】过氧化钠保存不当容易变质。某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取2.0g样品,并设计用下图装置来测定过氧化钠的质量分数。图中的E和F构成量气装置,用来测定O2的体积。
| |||||
A | B | C | D | E | F |
(1)写出装置A中两种主要玻璃仪器的名称__________、_______。
(2)写出装置A中发生的离子方程式____________________________。
(3)装置B的作用是______________________________。
(4)写出装置C中发生反应的主要化学方程式:______________________________。
(5)装置D中 NaOH的作用是________________________________________。
(6)他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为__________
【题目】硫酸镍(NiSO4)是一种重要的化工原料,广泛应用于电镀、医药、印染等工业。以含镍废催化剂(主要含Ni及少量的Al、Al2O3、Fe和其它不溶于酸、碱的杂质)为原料生产NiSO4·7H2O晶体的两种工艺流程如下:
流程一:
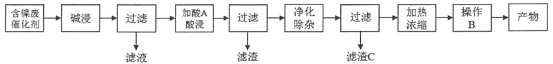
流程二:

已知:部分金属氢氧化物的Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
回答下列问题:
(1)流程一中所用酸A和流程二中所用酸X___________(填“相同”或“不相同”);流程一中滤渣C和流程二中滤渣II___________(填“相同”或“不相同”)。流程二中滤渣I是___________。
(2)流程一中“碱浸”时发生反应的离子方程式为_________________、___________________。
(3)流程二中“净化除杂”包含了两步操作过程:第一步,加入氧化剂H2O2,发生反应的离子方程式是____________________________________________;第二步,调节溶液的pH。
(4)分析比较流程一中操作B和流程二中操作Y后,回答操作Y是___________、___________、过滤、洗涤、干燥,即得产物。
(5)由己知信息列式计算:常温下,Ni2+完全沉淀时的pH值___________。