题目内容
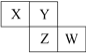
【题目】固体化合物 X 由 3 种元素组成。某学习小组进行了如下实验:
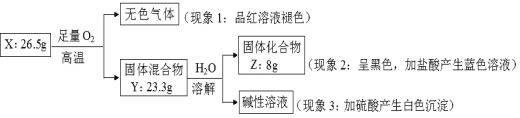
请回答:
(1)由现象 1 得出化合物 X 含有_____________元素(填元素符号),X 的化学式_____________。
(2)固体混合物 Y 的成分_____________ (填化学式)。
(3)实验室常将氨气(NH3)通过红热的黑色固体化合物 Z 制备氮气,该反应的化学方程式是_____________。
【答案】S BaCuS2 BaO和CuO 2NH3+3CuO3=Cu+N2↑+3H2O
【解析】
根据现象1可知,无色气体为SO2,向黑色固体化合物Z中加入盐酸,溶液呈蓝色,说明固体Z为CuO,向碱性溶液中加硫酸会产生白色沉淀,说明该溶液中含有Ba2+,由此可知,固体混合物Y中含有BaO,据此解答本题。
(1)根据上述分析可知,X中含有S元素,固体化合物Z的物质的量为:![]() =0.1mol,固体混合物中BaO的质量为23.3g-8g=15.3g,BaO的物质的量为:
=0.1mol,固体混合物中BaO的质量为23.3g-8g=15.3g,BaO的物质的量为:![]() =0.1mol,因此固体X中S元素的物质的量为:
=0.1mol,因此固体X中S元素的物质的量为:![]() =0.2mol,N(Cu):N(Ba):N(S)=1:1:2,故X的化学式为:BaCuS2,
=0.2mol,N(Cu):N(Ba):N(S)=1:1:2,故X的化学式为:BaCuS2,
故答案为:S;BaCuS2;
(2)由上述分析可知,Y的主要成分为:CuO和BaO,
故答案为:CuO和BaO;
(3)氨气与氧化铜在高温条件下反应,生成铜、氮气、水,其化学反应方程式为:![]() ,
,
故答案为:![]() 。
。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.含硫的煤燃烧时会产生SO2,对空气造成污染,且易形成酸雨。
(1)为了防治酸雨,工业上常用生石灰和含硫的煤混合后燃烧,燃烧时生成的SO2和生石灰、O2共同反应生成硫酸钙。请写出该反应的化学方程式___。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
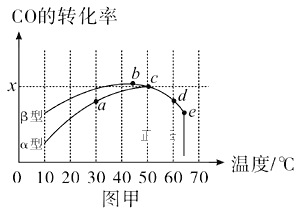
(2)a、b、c、d四点中,达到平衡状态的是__。
(3)已知c点时容器中O2浓度为0.02mol/L,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=__(用含x的代数式表示)。
(4)下列关于图甲的说法正确的是__。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高至一定温度后,催化剂失去活性
Ⅲ.活性炭还原法也是消除氮氧化物和硫氧化物的方法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:
C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=QkJ·mol-1
N2(g)+CO2(g) ΔH=QkJ·mol-1
在T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.40 | 0.20 | 0.30 | 0.60 | |
N2 | 0 | 0.40 | 0.60 | 0.60 | ||
CO2 | 0 | 0.60 | 0.60 |
(5)0~10min内,N2的平均反应速率v(N2)=__。
(6)若30min后升高温度至T2℃,重新达到平衡时,容器中NO、N2、CO2的浓度之比为7∶3∶3,则该反应的ΔH__0(填“>”、“=”、或“<”)