题目内容
【题目】已知:
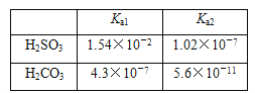
(1)在相同浓度的H2SO3和H2CO3的溶液中,用“>”“<”或“=”填空。
c(H+):H2SO3________H2CO3;c(SO![]() )________c(CO
)________c(CO![]() );c(H2SO3)________c(H2CO3);溶液导电能力:H2SO3________H2CO3。
);c(H2SO3)________c(H2CO3);溶液导电能力:H2SO3________H2CO3。
(2)HSO![]() 的电离平衡常数表达式为________________。
的电离平衡常数表达式为________________。
(3)H2SO3溶液与NaHCO3溶液反应的主要离子方程式为____________________。
【答案】 > > < > Ka=![]() H2SO3+HCO
H2SO3+HCO![]() ===H2O+CO2↑+HSO
===H2O+CO2↑+HSO![]()
【解析】(1)根据电离平衡常数可知酸性强弱顺序是:H2SO3>H2CO3>HSO3->HCO3-,酸性越强,电离程度越大,则在相同浓度的H2SO3和H2CO3的溶液中,c(H+):H2SO3>H2CO3;c(SO32-)>c(CO32-);c(H2SO3)<c(H2CO3);溶液中离子浓度越大,导电性越强,则溶液导电能力:H2SO3>H2CO3。(2)HSO3-的电离方程式为HSO3-![]() SO32-+H+,则电离平衡常数表达式为
SO32-+H+,则电离平衡常数表达式为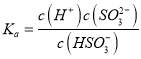 。(3)根据酸性强弱依据较强酸制备较弱酸可知H2SO3溶液与NaHCO3溶液反应的主要离子方程式为 H2SO3+HCO3-===H2O+CO2↑+HSO3-。
。(3)根据酸性强弱依据较强酸制备较弱酸可知H2SO3溶液与NaHCO3溶液反应的主要离子方程式为 H2SO3+HCO3-===H2O+CO2↑+HSO3-。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目