题目内容
下列说法正确的是( )
| A.凡是放热反应都是自发的,因为吸热反应都是非自发的 |
| B.自发反应的熵一定增大,非自发反应的熵一定减小 |
C.常温下,反应C(s)+CO2(g)  2CO(g)不能自发进行,则该反应的ΔH>0 2CO(g)不能自发进行,则该反应的ΔH>0 |
| D.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH>0 |
C
解析

练习册系列答案
相关题目
可逆反应aX(g)+bY(g) cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图像如图。下列说法正确的是( )
cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图像如图。下列说法正确的是( )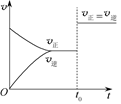
| A.若a+b=c,则t0时只能是增大反应体系的压强 |
| B.若a+b=c,则t0时只能是加入催化剂 |
| C.若a+b≠c,则t0时只能是加入催化剂 |
| D.若a+b≠c,则t0时只能是增大体系的压强 |
在容积为2 L的3个密闭容器中发生反应3A(g)+B(g) xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
| 到达平衡的时间(min) | 5 | | 8 |
| A的浓度(mol/L) | c1 | c2 | |
| C的体积分数 | w1 | | w3 |
| 混合气体密度(g/L) | ρ1 | ρ2 | |
下列说法正确的是( )
A.若x<4,则2c1<c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
[双选题]对于反应2X+Y 2Z(正反应为放热反应),若升高温度则能使( )
2Z(正反应为放热反应),若升高温度则能使( )
| A.反应速率不变,Z的产量减少 |
| B.反应速率增大,Z的产量减少 |
| C.反应速率增大,Y的转化率降低 |
| D.反应速率减小,Z的产量增大 |
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生
反应:H2NCOONH4(s)  2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
| 温度 | 平衡浓度(mol·L-1) | |
| | c(NH3) | c(CO2) |
| T1 | 0.1 | |
| T2 | | 0.1 |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
在容积一定的密闭容器中,反应A(?)+B(g)  C(g)+D(g)达到平衡后,升高温度容器
C(g)+D(g)达到平衡后,升高温度容器
内气体的密度增大,则下列叙述正确的是( )
| A.正反应是放热反应 |
| B.A不是气态物质,加入A该平衡向正反应方向移动 |
| C.其他条件不变,加入A平衡不移动 |
| D.改变压强对该平衡的移动无影响 |
下图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )
2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )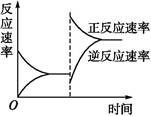
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1
2XY3(g) ΔH=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热:23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
下列叙述不正确的是( )
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达到平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①的体积为0.20 L,则达平衡时放出的热量大于23.15 kJ