题目内容
【题目】Cu、Fe、Se、Co、Si常用于化工材料的合成。请回答下列问题:
(1)铁离子(Fe3+)最外层电子排布式为______,其核外共有______种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是____________________________________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为________(用元素符号表示)。
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有____、_____。
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式_____,HCN分子的空间构型为____________。
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。
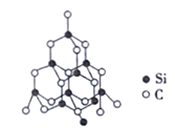
在SiC晶体中,C原子的杂化方式为_________,每个Si原子被_______个最小环所共有。
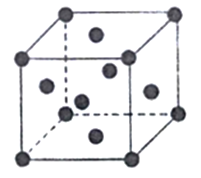
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为____mol-1。
【答案】 3s23p63d5 23 Fe3+的电子排布为[Ar]3d5,3d轨道为半充满状态,比Fe2+电子排布[Ar]3d6更稳定 Br>Se>As 共价键 配位键 CO 直线形 sp3 12 256/a3p
【解析】(1)Fe为26号元素,Fe3+的核外电子排布式为[Ar]3d5,最外层电子排布式为3s23p63d5;其核外共有2种不同运动状态的电子;Fe3+的电子排布为[Ar]3d5,3d轨道为半充满状态,比Fe2+电子排布[Ar]3d6更稳定;(2)As、Se、Br属于同一周期且原子序数逐渐增大,元素的非金属性逐渐增强,电负性逐渐增强,所以3种元素的电负性从大到小顺序为Br>Se>As;(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有共价键、配位键;(4)等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团,与CN-互为等电子体的极性分子有CO;HCN分子中心原子碳原子为sp杂化,分子的空间构型为直线型;(5)SiC中C与Si形成4个σ键,为sp3杂化;;以1个Si为标准计算,1个Si通过O连接4个Si,这4个Si又分别通过O连有其他3个Si,故每个Si被4×3=12个最小环所共有;(6)已知Cu的晶胞结构如图,为面心立方,每个晶胞含有Cu个数为8×![]() +6×
+6×![]() =4,棱长为acm,则晶胞的体积V=a3cm3,又知Cu的密度为pg/cm3,则pg/cm3=
=4,棱长为acm,则晶胞的体积V=a3cm3,又知Cu的密度为pg/cm3,则pg/cm3=![]() ,故NA=
,故NA=![]() 。
。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】利用硫铁矿烧渣(主要成分为Fe2O3,还含有少量Al2O3、 MgO、SiO2等杂质)制备铁红工艺流程如下:

回答下列问题:
(1)还原焙烧后,Fe元素的化合价为__________。
(2)“酸浸”实验中,需加入絮凝剂沉淀杂质。絮凝剂用量和过滤时间对铁红成份的影响如下表所示。由表可知,所采用的最佳实验条件为__________。
絮凝剂用量/×10-6t | 过滤时间min | Fe2O3含量% | SiO2含量% |
40 | 5 | 96.5 | 0.12 |
50 | 10 | 97.9 | 0.10 |
60 | 20 | 98.3 | 0.07 |
100 | 40 | 99.4 | 0.01 |
150 | 150 | 99.5 | 0.008 |
(3)若“合成”中c(Mg2+)=0.01mol/L,加入NH4HCO3(设溶液体积增加1倍),当Fe2+恰好沉淀完全时,溶液中c(Fe2+)=1.0×10-5mol/L,此时是否有MgCO3沉淀生成?_______(列式计算)。FeCO3、MgCO3的Ksp分别为3.2×10-11、3.0×10-8。
(4)“合成”过程中发生反应的离子方程式为_____________.
(5)“合成”过程中温度对亚铁离子转化率的影响如下图,分析选择反应温度为40℃的原因是________。

(6)“煅烧”中由FeCO3制备Fe 2O3的化学方程式为___________。
(7)本流程中,铝元素是以________(填化学式)形式被除去的。
【题目】某研究小组用如图所示装置制取乙酸乙酯,相关信息及实验步骤如下。

物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | — | 338.0 | 1.84 |
实验步骤:①在试管a中加入浓硫酸,乙醇和冰醋酸各2ml;②将试管a固定在铁架台上;③在试管b中加入适量的饱和碳酸钠溶液;④按图连接好装置后,用酒精灯对试管a缓慢加热(小火均匀加热) ;⑤待试管b收集到一定量产物后停止加热,撤去试管b并用力震荡试管b,然后静置。请回答下列问题:
(1)写出制取乙酸乙酯的化学方程式(注明反应条件):___________;
(2)装置中的球形干燥管除起冷凝作用外,它的另一重要作用是_____________________;
(3)试管b中饱和碳酸钠溶液的作用是___________(填选项);
A.中和乙酸并吸收部分乙醇 B.中和乙酸和乙醇
C.降低乙酸乙酯的溶解度,有利于分层析出 D.加速酯的生成,提高其产率
(4) 步骤④中需要用小火均匀加热,其主要原因是_________________________________________;
(5)指出步骤⑤静置后,试管b中所观察到的实验现象:___________________________________;
(6)下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图:

在上述实验过程中,所涉及的三次分离操作是___________(填选项)。
A.①蒸馏②过滤③分液 B. ①分液②蒸馏③结晶、过滤
C.①蒸馏②分液③分液 D.①分液②蒸馏③蒸馏

